Реакцията на съединението. Примери за реакция на съединение
Много процеси, без които не е възможно да си представим нашия живот (като дишане, храносмилане, фотосинтеза и други подобни), са свързани с различни химични реакции на органични съединения (и неорганични). Нека да разгледаме основните типове и ще разгледаме по-подробно процеса, наречен връзка (свързване).
съдържание
- Това, което се нарича химическа реакция
- Какви са видовете химически процеси
- Видове химични процеси в неорганичната химия чрез метода на взаимодействие
- Типове процеси по метода на взаимодействие в органичната химия
- Химическата реакция на съединението
- Реакционното уравнение на съединението
- Условия за реакция в неорганични съединения
- Видове реакции на добавяне в органичната химия
- Примери на реакцията на присъединяване (съединение)
Това, което се нарича химическа реакция
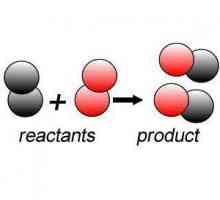
На първо място, струва си да се даде обща дефиниция на това явление. С разглежданата фраза се означават различни реакции на вещества с различна сложност, в резултат на което се образуват различни продукти от първоначалните продукти. Веществата, включени в този процес, се наричат "реагенти". 
На писмото химичната реакция на органичните съединения (и неорганичните) се записва, като се използват специализирани уравнения. Навън те ни напомнят малко за математическите примери за добавяне. Въпреки това, вместо знака ("=") се използва стрелката ("→" или "⇆"). Освен това понякога може да има повече вещества в дясната страна на уравнението, отколкото вляво. Всичко, което е преди стрелката, са вещества преди началото на реакцията (лявата страна на формулата). Всичко, което е след него (от дясната страна) - съединенията, образувани в резултат на извършения химичен процес.
Като пример за химическо уравнение може да се разгледа реакция на разпадане вода до водород и кислород под въздействието на електрически ток: 2Н2О - 2Н2uarr- + За2uarr-. Водата е изходният реагент, а кислородът с водород е продукт.
Като друг, но по-сложен пример за химичната реакция на съединенията, може да се разгледа едно явление, познато на всяка любовница, която най-малко веднъж изпече бонбони. Това е въпрос на гасене на сода за хляб с помощта на оцет на трапеза. Действието е илюстрирано със следното уравнение: NaHCO3 +2 CH3COOH → 2CH3COONa + CO2urr- + H2От това става ясно, че натриевата сол на оцетната киселина, водата и въглеродния диоксид се образуват по време на взаимодействието на натриев хидрогенкарбонат и оцет.
По природа химични процеси заема междинно място между физически и ядрени.
За разлика от първото, съединенията, участващи в химическите реакции, могат да променят състава си. Тоест, от атомите на едно вещество, могат да се образуват няколко други, както в гореспоменатото уравнение за разграждането на водата.
За разлика от ядрените реакции, химичните реакции не засягат ядрата на атомите на взаимодействащите вещества.
Какви са видовете химически процеси
Разпределението на реакциите на съединенията по видове се извършва съгласно различни критерии:
- Обратимост / необратимост.
- Наличие / отсъствие на катализиращи агенти и процеси.
- От абсорбцията / освобождаването на топлина (ендотермична / екзотермична реакция).
- Чрез броя на фазите: хомогенни / хетерогенни и два хибридни разновидности от тях.
- Чрез промяна на степента на окисление на взаимодействащите вещества.
Видове химични процеси в неорганичната химия чрез метода на взаимодействие
Този критерий е специален. С негова помощ се разграничават четири вида реакции: съединение, заместване, разлагане (разцепване) и обмен. 
Името на всеки от тях съответства на описания от него процес. Това означава, че в съединението веществата се комбинират в замяна - те се сменят с други групи, няколко от които се образуват в разлагането от един реагент, а в замяна участниците в реакцията се различават помежду си от атоми.
Типове процеси по метода на взаимодействие в органичната химия
Независимо от голямата сложност, реакциите на органичните съединения протичат на същия принцип като неорганичните. Те обаче имат няколко различни имена.
По този начин реакциите на съединението и разграждането се наричат "добавяне", както и "разделяне" (елиминиране) и директно органично разлагане (в този раздел на химията съществуват два вида процеси на разцепване).
Другите реакции на органичните съединения са заместването (името не се променя), пренареждането (обмен) и процесите на окисляване и редукция. Въпреки сходството на техните механизми, в органичните, те са по-гъвкави.
Химическата реакция на съединението
След като обсъдихме различни видове процеси, включващи вещества в органичната и неорганичната химия, струва си да се разгледаме по-подробно точно върху връзката.
Тази реакция се различава от всички останали в това, че независимо от количеството на реагентите в началото, във финала всички те се съчетават в едно.
Като пример можем да припомним процеса на охлаждане на вар: CaO + H2О - Ca (OH)2. В този случай протича реакция между калциевия оксид (негасена вар) и водородния оксид (вода). В резултат на това се образува калциев хидроксид (вар) и се отделя гореща пара. Между другото, това означава, че този процес наистина е екзотермичен.
Реакционното уравнение на съединението
Схематично, разглежданият процес може да бъде представен, както следва: A + BV → ABC. В тази формула ABC е новоформирано сложно вещество, А е прост реагент и BV е вариант на сложно съединение.

Трябва да се отбележи, че тази формула е характерна и за процеса на добавяне и свързване.
Примери за разглежданата реакция са взаимодействието на натриев оксид и въглероден диоксид (NaO2 + CO2(450-550 ° С) → Na2CO3), както и оксид на сяра с кислород (2S0)2 + О2urr-> 2SO3).
Също така, няколко съединения са способни да взаимодействат една с друга: AB + VH → ABHG. Например, всички същите натриев оксид и водороден оксид: NaO2 +Н20 → 2NaOH.
Условия за реакция в неорганични съединения
Както беше показано в предишното уравнение, веществата с различна степен на сложност могат да влязат в разглежданото взаимодействие. 
В този случай за прости реактиви с неорганичен произход са възможни окислително-редукционни реакции на съединението (А + В - АВ).
Като пример можем да разгледаме процеса на получаване на тривалентна железен хлорид. За тази цел реакцията на съединението между хлор и желязо се извършва: 3С12urr- + 2Fe -> 2FeCl3.
В случай, че е сложно взаимодействие на неорганични вещества (SH + AB → ABCD), процесите могат да се появят като засягат или не засягат тяхната валентност.
Като илюстрация за това трябва да се разгледа примера за образуване на калциев хидрогенкарбонат от въглероден диоксид, водороден окис и бяло оцветяване на храни E170 (калциев карбонат): CO2urr- + H2O + CaCO3 → Ca (CO3)2. В този случай протича класическата реакция на съединението. Когато се извършва, валентността на реагентите не се променя.
По-перфектно (от първото) химическо уравнение 2FeCl2 + Cl2uarr → 2FeCl3 е пример за процес на окисление-редукция при взаимодействието на прости и сложни неорганични реактиви: газ (хлор) и сол (железен хлорид).
Видове реакции на добавяне в органичната химия
Както вече беше посочено в четвъртата алинея, веществата от органичен произход разглеждат въпросната реакция като "принадлежност". По правило той включва сложни вещества с двойна (или тройна) връзка. 
Например, реакцията между дибромо и етилен, водеща до образуването на 1,2-дибромоетан (С.2Н4) CH2= СН2 + Br2 - (C2H4Br2) BrCH2 - СН2Бр. Между другото, знаци, подобни на равни и отрицателни ("=" и ";"), в това уравнение показват връзките между атомите на сложно вещество. Това е характеристика на писмените формули за органични вещества.
В зависимост от това кое от съединенията действат като реагенти, се разграничават няколко разновидности на процеса на прикачване:
- Хидрогениране (добавете водородни молекули Н върху множествена връзка).
- Хидрохалогениране (прикрепен е водороден халогенид).
- Халогениране (прибавяне на Br халогени2, Cl2uarr и други подобни).
- Полимеризация (образуване от няколко нискомолекулни съединения на вещества с високо молекулно тегло).
Примери на реакцията на присъединяване (съединение)
След изброяването на разновидностите на разглеждания процес е целесъобразно да се научат на практика някои примери за реакцията на съединението.
Като илюстрация на хидрогенирането, можем да обърнем внимание на уравнението на взаимодействието на пропена с водород, в резултат на което ще възникне пропан: (С3Н6urr-) CH3-СН = СН2uarr- + Н2uarr- → (С3Н8urr-) CH3СН2СН3uarr-.
В органичната химия реакцията на съединението (добавяне) може да се осъществи между солна киселина (неорганично вещество) и етилен с образуването на хлороетан: (С2Н4urr-) CH2= СН2urr- + HCI -> СН3- CH2-С1 (С2Н5Cl). Представеното уравнение е пример за хидрохалогениране. 
По отношение на халогенирането, това може да бъде илюстрирано чрез взаимодействието между дихлоро и етилен, което води до образуването на 1,2-дихлороетан: (С2Н4urr-) CH2= СН2 + Cl2urr- (С2Н4С12) С1СН2-СН2Cl.
Много от полезните вещества се образуват благодарение на органичната химия. Реакцията на съединението (прикрепването) на молекулите на етилена с радикалния инициатор на полимеризацията под въздействието на ултравиолетови се потвърждава от това:2 = СН2 (R и ултравиолетова светлина) → (-CH2-СН2-) n. Веществото, образувано по този начин, е добре известно на всеки човек под името на полиетилен.

От този материал се произвеждат различни видове опаковки, опаковки, прибори, тръби, изолационни материали и много други неща. Характеристика на това вещество е възможността за рециклирането му. Неговата популярност полиетилен поради факта, че тя не се разлага, поради което природозащитниците негативно го разглеждат. През последните години обаче е открит метод за безопасно изхвърляне на полиетиленови продукти. За тази цел материалът се обработва с азотна киселина (HNO3). След това някои видове бактерии могат да разградят това вещество в безвредни компоненти.
Реакцията на съединението (прикрепването) играе важна роля в природата и човешкия живот. В допълнение, често се използва от учени в лабораториите за синтезиране на нови вещества за различни важни изследвания.
 Реакция на съединението: Примери и формула
Реакция на съединението: Примери и формула Реакция на разпадане: примери и уравнение
Реакция на разпадане: примери и уравнение Каква е реакцията на разлагане в химията? Примери на реакцията на разлагане
Каква е реакцията на разлагане в химията? Примери на реакцията на разлагане Органичните вещества имат своите характеристики и класификация
Органичните вещества имат своите характеристики и класификация Качествени реакции към органични вещества, аниони, катиони
Качествени реакции към органични вещества, аниони, катиони Химични свойства на алкините. Структура, приемане, приложение
Химични свойства на алкините. Структура, приемане, приложение Хомогенни реакции.
Хомогенни реакции. Циклични наситени въглеводороди: как се произвеждат. циклоалкани
Циклични наситени въглеводороди: как се произвеждат. циклоалкани Неорганични вещества
Неорганични вещества Нека да поговорим за това как да определим вида на хибридизацията
Нека да поговорим за това как да определим вида на хибридизацията Химически уравнения: как да се реши най-ефективно
Химически уравнения: как да се реши най-ефективно Органични въпроси: примери. Примери за образуване на органични и неорганични вещества
Органични въпроси: примери. Примери за образуване на органични и неорганични вещества Органични съединения и тяхната класификация
Органични съединения и тяхната класификация Класификация на химическите реакции
Класификация на химическите реакции Фактори, влияещи върху скоростта на химическата реакция
Фактори, влияещи върху скоростта на химическата реакция Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията
Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията Как да уредим коефициентите в химическите уравнения? Химични уравнения
Как да уредим коефициентите в химическите уравнения? Химични уравнения Неорганични вещества: примери и свойства
Неорганични вещества: примери и свойства Каква е каталитичната реакция? Основни принципи и видове
Каква е каталитичната реакция? Основни принципи и видове Ред на реакция: концепция, видове
Ред на реакция: концепция, видове Кислородсъдържащи съединения: примери, свойства, формули
Кислородсъдържащи съединения: примери, свойства, формули