Схема на структурата на атома: ядро, електронна обвивка. примери
Нека да разгледаме как е построен атом. Имайте предвид, че ще бъде изключително за моделите. На практика атомите са много по-сложна структура. Но благодарение на съвременните разработки, ние сме в състояние да обясним и дори успешно да предсказваме свойствата химични елементи
съдържание
Планетарният модел на атома
 Първоначално тя е предложена от датския физик Н. Бор през 1913 година. Това е първата теория за структурата на атома, основана на научни факти. В допълнение, той постави основата за съвременната тематична терминология. В него частиците-електрони произвеждат ротационни движения около атома според същия принцип като планетите около Слънцето. Бор предполага, че те могат да съществуват само в орбити на точно определено разстояние от ядрото. Защо това е така, учен от позицията на науката не може да обясни, но такъв модел беше потвърден от много експерименти. За да се обозначат орбитите, бяха използвани цели числа, започващи с номера, който е най-близък до сърцевината. Всички тези орбити също се наричат нива. Водородният атом има само едно ниво, на което един електронен се върти. Но сложните атоми имат повече нива. Те са разделени на компоненти, които комбинират електрони в близост до енергийния потенциал. Така че, втората вече има две подложки - 2s и 2p. Третият вече има три - 3s, 3p и 3d. И така нататък. На първо място, подлезите по-близо до ядрото са населени, а след това и далечните. На всеки от тях може да бъде поставен само определен брой електрони. Но това не е краят. Всеки субливан е разделен на орбити. Нека сравним с нормалния живот. Електронният облак на атома е сравним с този на града. Нивата са улици. Под-ниво е частна къща или апартамент. Орбиталът е стая. Във всеки от тях "живее" един или два електрона. Всички те имат конкретни адреси. Това беше първата схема на структурата на атома. И накрая за адресите на електроните: те се определят от множества от числа, които се наричат "квантови".
Първоначално тя е предложена от датския физик Н. Бор през 1913 година. Това е първата теория за структурата на атома, основана на научни факти. В допълнение, той постави основата за съвременната тематична терминология. В него частиците-електрони произвеждат ротационни движения около атома според същия принцип като планетите около Слънцето. Бор предполага, че те могат да съществуват само в орбити на точно определено разстояние от ядрото. Защо това е така, учен от позицията на науката не може да обясни, но такъв модел беше потвърден от много експерименти. За да се обозначат орбитите, бяха използвани цели числа, започващи с номера, който е най-близък до сърцевината. Всички тези орбити също се наричат нива. Водородният атом има само едно ниво, на което един електронен се върти. Но сложните атоми имат повече нива. Те са разделени на компоненти, които комбинират електрони в близост до енергийния потенциал. Така че, втората вече има две подложки - 2s и 2p. Третият вече има три - 3s, 3p и 3d. И така нататък. На първо място, подлезите по-близо до ядрото са населени, а след това и далечните. На всеки от тях може да бъде поставен само определен брой електрони. Но това не е краят. Всеки субливан е разделен на орбити. Нека сравним с нормалния живот. Електронният облак на атома е сравним с този на града. Нивата са улици. Под-ниво е частна къща или апартамент. Орбиталът е стая. Във всеки от тях "живее" един или два електрона. Всички те имат конкретни адреси. Това беше първата схема на структурата на атома. И накрая за адресите на електроните: те се определят от множества от числа, които се наричат "квантови".
Моделът на вълната на атома
 Но с течение на времето планетарният модел претърпя ревизия. Бе предложена втората теория за структурата на атома. Тя е по-добра и ни позволява да обясним резултатите от практическите експерименти. Моделът на вълната на атома, предложен от Е. Шрьодингер, замени първия. Тогава вече беше установено, че един електрон може да се прояви не само като частица, но и като вълна. И какво направи Шрьодингер? Той приложи уравнението, описващо движението на вълната в триизмерното пространство. По този начин не може да се намери траекторията на движението на електрона в атом, а вероятността за откриването му в определена точка. Комбинирането на двете теории е, че елементарните частици са на специфични нива, подлези и орбити. На това сходство на моделите завършва. Ще дам един пример - в теорията на вълните, орбиталът е регионът, в който може да се намери електрон с вероятност 95%. Цялото останало пространство е 5%, но в крайна сметка се оказа, че характеристиките на структурата на атомите са изобразени с помощта на вълновия модел, докато използваната терминология е обща.
Но с течение на времето планетарният модел претърпя ревизия. Бе предложена втората теория за структурата на атома. Тя е по-добра и ни позволява да обясним резултатите от практическите експерименти. Моделът на вълната на атома, предложен от Е. Шрьодингер, замени първия. Тогава вече беше установено, че един електрон може да се прояви не само като частица, но и като вълна. И какво направи Шрьодингер? Той приложи уравнението, описващо движението на вълната в триизмерното пространство. По този начин не може да се намери траекторията на движението на електрона в атом, а вероятността за откриването му в определена точка. Комбинирането на двете теории е, че елементарните частици са на специфични нива, подлези и орбити. На това сходство на моделите завършва. Ще дам един пример - в теорията на вълните, орбиталът е регионът, в който може да се намери електрон с вероятност 95%. Цялото останало пространство е 5%, но в крайна сметка се оказа, че характеристиките на структурата на атомите са изобразени с помощта на вълновия модел, докато използваната терминология е обща.
Понятието за вероятност в този случай
 Защо е използван този термин? Хайзенберг през 1927 г. формулира принципа на несигурност, който сега се използва за описание на движението на микрочастиците. Тя се основава на основната им разлика от обикновените физически тела. Какво е това? Класическата механика предполага, че човек може да наблюдава явления, без да ги засяга (наблюдава небесните тела). Въз основа на получените данни можете да изчислите къде ще бъде обектът в определен момент от времето. Но в микрокосмоса на бизнеса нещата трябва да бъдат различни. Така например, за да наблюдаваме електрона без да го засягаме, сега не е възможно с оглед на факта, че енергиите на инструмента и частиците не са сравними. Това води до промяна в местоположението на елементарните частици, състояние, посока, скорост и други параметри. И е безсмислено да се говори за точни характеристики. Самият принцип на несигурност ни казва, че е невъзможно да се изчисли точната траектория на полета на електрона около ядрото. Може да се посочи само вероятността да се намери частица в определена област от пространството. Такава характеристика има структурата на атомите на химическите елементи. Но това трябва да се има предвид само от учените в практически експерименти.
Защо е използван този термин? Хайзенберг през 1927 г. формулира принципа на несигурност, който сега се използва за описание на движението на микрочастиците. Тя се основава на основната им разлика от обикновените физически тела. Какво е това? Класическата механика предполага, че човек може да наблюдава явления, без да ги засяга (наблюдава небесните тела). Въз основа на получените данни можете да изчислите къде ще бъде обектът в определен момент от времето. Но в микрокосмоса на бизнеса нещата трябва да бъдат различни. Така например, за да наблюдаваме електрона без да го засягаме, сега не е възможно с оглед на факта, че енергиите на инструмента и частиците не са сравними. Това води до промяна в местоположението на елементарните частици, състояние, посока, скорост и други параметри. И е безсмислено да се говори за точни характеристики. Самият принцип на несигурност ни казва, че е невъзможно да се изчисли точната траектория на полета на електрона около ядрото. Може да се посочи само вероятността да се намери частица в определена област от пространството. Такава характеристика има структурата на атомите на химическите елементи. Но това трябва да се има предвид само от учените в практически експерименти.
Състав на атома
Но нека се съсредоточим върху целия предмет на разглеждане. Така че, в допълнение към добре обмислената електронна обвивка, вторият компонент на атома е ядрото. Състои се от положително заредени протони и неутрални неутрони. Всички сме запознати с масата на Менделеев. Броят на всеки елемент съответства на броя на протоните, които съдържа. Броят на неутроните е равен на разликата между масата на атома и неговия брой протони. Възможно е да има отклонения от това правило. Тогава те казват, че има изотоп на елемента. Схемата на структурата на атома е такава, че е "заобиколена" от електронната обвивка. Броят на електроните обикновено е равен на броя на протоните. Масата на последната е приблизително 1840 пъти по-голяма от тази на първата и е приблизително равна на теглото на неутрона. Радиусът на сърцевината е около 1/200000 от диаметъра на атома. Самата тя има сферична форма. Това като цяло е структурата на атомите на химическите елементи. Въпреки разликата в масата и свойствата, те изглеждат еднакво.
Орбитите
 Говорейки за това какво е схема на структурата на атома, не можете да мълчите за тях. Така че има такива видове:
Говорейки за това какво е схема на структурата на атома, не можете да мълчите за тях. Така че има такива видове:
- с. Те имат сферична форма.
- стр. Подобни са на обемни фигури или шпиндели.
- d и f. Те имат сложна форма, която трудно може да се опише с формален език.
Всеки тип електрони може да бъде открит с вероятност от 95% на територията на съответните орбитали. Представената информация трябва да се третира спокойно, защото е по-скоро абстрактен математически модел, отколкото физическо реално състояние. Но с всичко това, той има добра прогностична сила по отношение на химическите свойства на атомите и дори на молекулите. Колкото по-навътре от ядрото се намира нивото, толкова повече електрони могат да бъдат поставени върху него. По този начин броят на орбитите може да се изчисли, като се използва специална формула: x2. Тук х е равен на броя на нивата. И тъй като до орбиталите могат да бъдат поставени до два електрона, формулата на тяхното числено търсене в крайна сметка ще изглежда така: 2x2.
Орбити: технически данни

Ако говорим за структурата на атома на флуор, той ще има три орбита. Всички те ще бъдат изпълнени. Енергията на орбитата в рамките на една и съща подложка е една и съща. За да ги маркирате, добавете номер на слой: 2s, 4p, 6d. Връщаме се в разговора за структурата на флуорен атом. Той ще има два s- и един p-subblevels. Той има девет протона и един и същ брой електрони. Първо първо ниво. Това са два електрона. Тогава второто ниво. Още два електрона. И 5 попълнете p-ниво. Ето неговата структура. След като прочетете следващия субтитър, можете сами да направите необходимите действия и да се уверите сами. Ако говорим за това физичните свойства на халогени, които включват флуор, трябва да се отбележи, че те, въпреки че в същата група, напълно се различават по техните характеристики. Така че тяхната точка на кипене варира от -188 до 309 градуса по Целзий. Защо са обединени? Всичко това се дължи на химическите свойства. Всички халогени и най-вече флуорът имат най-високата окислителна способност. Те реагират с метали и без проблеми могат да се самозапалят при стайна температура.
Как се запълват орбитите?
Какви са правилата и принципите на електроните? Предлагаме ви да се запознаете с трите основни, чиято формулировка е опростена за по-добро разбиране:
- Принципът на най-малко енергия. Електроните са склонни да запълват орбитите, за да увеличат своята енергия.
- Принципът на Паули. На един орбитал могат да се намерят не повече от два електрона.
- Правилото на Хунд. В рамките на една подложка, електроните запълват първо свободните орбитали и едва след това образуват двойки.
В областта на пълненето ще помогне периодична система на Менделеев, а структурата на атома в този случай ще стане по-ясна по отношение на имиджа. Ето защо, в практическата работа с изграждането на схеми на елементи, е необходимо да се запази на ръка.
пример
 За да се обобщи всичко, което беше казано в рамките на статията, е възможно да се направи проба как електроните на атома се разпределят над техните нива, подложки и орбитали (т.е. какви са конфигурацията на нивата). Тя може да бъде изобразена като формула, енергийна диаграма или като схема на слоеве. Тук има много добри илюстрации, които при внимателно разглеждане помагат да се разбере структурата на атома. Така че, първо попълнете първото ниво. В него има само един субливал, в който има само един орбитал. Всички нива се попълват последователно, като се започне с по-малка. Първо, в рамките на един субливан, един електронен на електронен се поставя на всяка орбита. След това се създават двойки. А при наличието на свободно се появява превключване към друг обект на пълнене. И сега можете самостоятелно да знаете каква е структурата на азотния атом или флуор (който беше разгледан по-рано). Първоначално може да е малко трудно, но можете да навигирате в картините. Нека да разгледаме структурата на азотния атом за яснота. Той има 7 протона (заедно с неутроните, които съставят ядрото) и същия брой електрони (които съставят електронната обвивка). Първо, попълнете първото ниво s. Той има 2 електрона. След това идва второто ниво. Има и 2 електрона върху него. И другите три са поставени на ниво р, където всеки от тях заема един орбитал всеки.
За да се обобщи всичко, което беше казано в рамките на статията, е възможно да се направи проба как електроните на атома се разпределят над техните нива, подложки и орбитали (т.е. какви са конфигурацията на нивата). Тя може да бъде изобразена като формула, енергийна диаграма или като схема на слоеве. Тук има много добри илюстрации, които при внимателно разглеждане помагат да се разбере структурата на атома. Така че, първо попълнете първото ниво. В него има само един субливал, в който има само един орбитал. Всички нива се попълват последователно, като се започне с по-малка. Първо, в рамките на един субливан, един електронен на електронен се поставя на всяка орбита. След това се създават двойки. А при наличието на свободно се появява превключване към друг обект на пълнене. И сега можете самостоятелно да знаете каква е структурата на азотния атом или флуор (който беше разгледан по-рано). Първоначално може да е малко трудно, но можете да навигирате в картините. Нека да разгледаме структурата на азотния атом за яснота. Той има 7 протона (заедно с неутроните, които съставят ядрото) и същия брой електрони (които съставят електронната обвивка). Първо, попълнете първото ниво s. Той има 2 електрона. След това идва второто ниво. Има и 2 електрона върху него. И другите три са поставени на ниво р, където всеки от тях заема един орбитал всеки.
заключение
 Както можете да видите, структурата на атома не е толкова труден въпрос (ако човек се доближи до него от гледна точка на курса на училищната химия, разбира се). И да се разбере тази тема не е трудно. Накрая искам да ви информирам за някои функции. Например, говорейки за структурата на кислородния атом, ние знаем, че има осем протона и 8-10 неутрона. И тъй като всичко в природата има тенденция към равновесие, два кислородни атома образуват молекула, където два недвоени електрона образуват ковалентна връзка. По същия начин, друга стабилна кислородна молекула - озон (О3). Познавайки структурата на кислородния атом, възможно е правилно да се формулират формули на окислителната реакция, в които участва най-богатата субстанция на Земята.
Както можете да видите, структурата на атома не е толкова труден въпрос (ако човек се доближи до него от гледна точка на курса на училищната химия, разбира се). И да се разбере тази тема не е трудно. Накрая искам да ви информирам за някои функции. Например, говорейки за структурата на кислородния атом, ние знаем, че има осем протона и 8-10 неутрона. И тъй като всичко в природата има тенденция към равновесие, два кислородни атома образуват молекула, където два недвоени електрона образуват ковалентна връзка. По същия начин, друга стабилна кислородна молекула - озон (О3). Познавайки структурата на кислородния атом, възможно е правилно да се формулират формули на окислителната реакция, в които участва най-богатата субстанция на Земята.
 Структурата на атома: какво е неутрон?
Структурата на атома: какво е неутрон? Модели на томовете на Томсън и Ръдърфорд за кратко
Модели на томовете на Томсън и Ръдърфорд за кратко Планетен модел на Ръдърфорд, атом в модела на Ръдърфорд
Планетен модел на Ръдърфорд, атом в модела на Ръдърфорд Структурата на атома. Кванто-механичен модел на атом
Структурата на атома. Кванто-механичен модел на атом Нека да поговорим как да намерите протони, неутрони и електрони
Нека да поговорим как да намерите протони, неутрони и електрони Основна информация за структурата на атома: характеристики, характеристики и формула
Основна информация за структурата на атома: характеристики, характеристики и формула Експериментът на Ръдърфорд за разсейване на алфа частици (за кратко)
Експериментът на Ръдърфорд за разсейване на алфа частици (за кратко) Структурата на атома
Структурата на атома Кой предложи ядрения модел на структурата на атома? Ядрен модел на атомната структура и нейната…
Кой предложи ядрения модел на структурата на атома? Ядрен модел на атомната структура и нейната… Постерата на Бора
Постерата на Бора Опитът на Ръдърфорд
Опитът на Ръдърфорд Какви са валентните електрони?
Какви са валентните електрони? Каква е вълнуващото състояние на атома
Каква е вълнуващото състояние на атома Експериментите на Ръдърфорд
Експериментите на Ръдърфорд Накратко за комплекса: структурата на електронните черупки на атомите
Накратко за комплекса: структурата на електронните черупки на атомите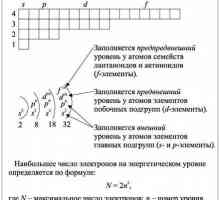 Външни енергийни нива: структурни особености и ролята им в взаимодействието между атомите
Външни енергийни нива: структурни особености и ролята им в взаимодействието между атомите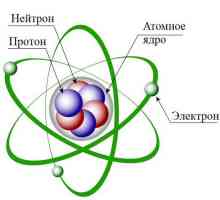 Какво означава зависимостта на броя на електроните в атома?
Какво означава зависимостта на броя на електроните в атома? Структурата на атомното ядро: историята на изследването и съвременните характеристики
Структурата на атомното ядро: историята на изследването и съвременните характеристики Планетарен модел на атома: теоретична оправданост и практически доказателства
Планетарен модел на атома: теоретична оправданост и практически доказателства От какво се състои атомът от която и да е субстанция?
От какво се състои атомът от която и да е субстанция?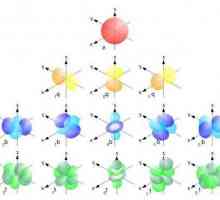 Електронна конфигурация - тайните на структурата на атома
Електронна конфигурация - тайните на структурата на атома