Хелий: свойства, характеристики, приложение
Хелият е инертен газ от 18-та група на периодичната таблица. Това е вторият най-лек елемент след водорода. Хелият е газ без цвят, мирис и вкус, който става течен при температура -268.9 ° С. Точката на кипене и точката на замръзване е по-ниска от тази на всяка друга известна субстанция. Това е единственият елемент, който не се втвърдява при охлаждане при нормално атмосферно налягане. За преминаване на хелий в твърдо състояние са необходими 25 атмосфери при температура 1 K.
съдържание
История на откритието
Хелий е намерен в газовата атмосфера на заобикалящата слънцето, френският астроном Пиер Zhansenom, че през 1868 година по време на слънчево затъмнение е открил ярко жълта линия в спектъра на слънчевата хромосферата. Първоначално се предполага, че тази линия представлява елементът натрий. През същата година английският астроном Джоузеф Норман Локър наблюдава жълта линия в слънчевия спектър, която не съответства на известния натриев D1 и D2, и така го нарече ред D3. Локър дойде до заключението, че е причинена от вещество на Слънцето, което не е известно на Земята. Той и химикът Едуард Франкланд в името на елемента използват гръцкото име на слънцето "хелиос".
През 1895 г. британският химик Сър Уилям Рамзи доказва съществуването на хелий на Земята. Той получи проба от уран-лагер минерална cleveite и след разглеждане на газове, образувани по време на нагряването, се установи, че на ярко жълто линия в спектъра съвпада с линията D3, наблюдавани в слънчевия спектър. По този начин най-накрая се установява новият елемент. През 1903 г. Рамзи и Фредерик Сод определят, че хелият е продукт на спонтанното разпадане на радиоактивни вещества.

Разпространение в природата
Масата на хелий е на около 23% от общата маса на Вселената, и елемент е вторият-често в пространството. Той се концентрира в звезди, където се образува от водород в резултат на термоядрен синтез. Въпреки че хелий в атмосферата е в концентрация от 1 част до 200-ти. (5 ррт) и се съдържа в малки количества радиоактивни минерали, метеорит жлеза, както и минерални източници, големи количества от намерени в САЩ (особено в Тексас, Ню елемент Мексико Сити, Канзас, Оклахома, Юта и Аризона) като компонент (до 7,6%) на природен газ. Неговите малки резерви са открити в Австралия, Алжир, Полша, Катар и Русия. В земната кора, концентрацията на хелий е само около 8 части на милиард.
изотопи
Ядрото на всеки хелиев атом съдържа два протона, но, както и други елементи, то има изотопи. Те съдържат от един до шест неутрона, така че техните масови номера са в диапазона от три до осем. Стабилни от тях са елементите, в които масата на хелий се определя от атомните числа 3 (3He) и 4 (4Той). Всички останали са радиоактивни и бързо се разпадат на други вещества. Земният хелий не е оригиналната съставна част на планетата, тя се формира в резултат на радиоактивно разпадане. Алфа-частиците, излъчвани от ядрата на тежките радиоактивни вещества, са ядрата на изотопа 4Той. Хелий не се натрупва в големи количества в атмосферата, защото земната гравитация не е достатъчно, за да се предотврати изтичане постепенно в космоса. песни 3Той е обяснен на Земята с отрицателното бета разпадане на рядък елемент от водород-3 (тритий). 4Той е най-често срещаният стабилен изотоп: съотношението на броя на атомите 4Той да 3Той е около 700 хил. До 1 в атмосферата и около 7 милиона до 1 в някои минерали, съдържащи хелий.

Физични свойства на хелий
Точката на кипене и точката на топене на този елемент са най-ниските. Поради тази причина, хелият съществува като газ, с изключение на екстремни условия. Газообразният Той във вода се разтваря по-малко от всеки друг газ, а скоростта на дифузия през твърди частици е три пъти по-голяма от тази на въздуха. Индексът на пречупване е най-близо до 1.
Топлинната проводимост на хелий е втора само на топлопроводимостта на водорода и неговата специфична топлина е необичайно висока. При обикновени температури, по време на разширяването се загрява и под 40 К се охлажда. Следователно, за T<40 К, хелият може да се превърне в течност чрез разширяване.
Елементът е диелектрик, ако не е в йонизирано състояние. Подобно на други благородни газове, хелият има метастабилни енергийни нива, които му позволяват да остане йонизиран при електрическо изпускане, когато напрежението остане под йонизационния потенциал.
Хелий-4 е уникален с това, че има две течни форми. Обичайната се нарича хелий I и съществува при температури от 4.21 K (-268.9 ° C) до около 2.18 K (-271 ° C). Под 2,18 К топлопроводимост 4Той става 1000 пъти повече от медта. Тази форма се нарича хелий II, за да я различи от обикновения. Той има превъзходство: вискозитетът е толкова нисък, че не може да бъде измерен. Хелий II се влива в тънък филм върху повърхността на всяко вещество, до което той се докосва, и този филм протича без триене, дори срещу гравитацията.
По-малко изобилие от хелий-3 образува три различни течни фази, две от които са суперфлуиди. Суперфлуидността в 4Той е открит от съветски физик Петър Леонидович Капитан в средата на 30-те години и същото явление в 3За първи път той се наблюдава от Дъглас Д. Ошеров, Дейвид М. Лий и Робърт С. Ричардсън от Съединените щати през 1972 г.
Течна смес от два изотопа на хелий-3 и -4 при температури под 0.8 K (-272.4 ° C) се разделя на два слоя - практически чисти 3Той и смесите 4Той е с 6% хелий-3. разтваряне 3Той влезе 4Той е придружен от охлаждащия ефект, който се използва в криостатни структури, в които температурата на хелий е под 0,01 К (-273,14 ° С) и се поддържа в продължение на няколко дни.

връзки
При нормални условия хелият е химически инертен. В крайни случаи е възможно да се създадат връзки на елементи, които при нормални условия на температура и налягане не са стабилни. Например, хелий може да образува съединения с йод, волфрам, флуор, фосфор и сяра, когато е подложен на електрически тлеещ разряд или чрез електронно бомбардиране в плазмата състояние. По този начин, HeNe, HgHe10, WHe2 и молекулни йони He2+, Не2++, хе+ и HeD+. Тази техника също направи възможно да се получат неутрални Мо молекули2 и HgHe.
плазма
Във Вселената йонизираният хелий е преобладаващо разпределен, чиито свойства се различават съществено от молекулярния. Електроните и протоните не са свързани и имат много висока електропроводимост, дори и в частично йонизирано състояние. Заредените частици са силно засегнати от магнитни и електрически полета. Например, в слънчев вятър, хелиевите йони заедно с йонизирания водород взаимодействат с магнитосферата на Земята, причинявайки северните светлини.

Откриване на депозити в САЩ
След пробиване на кладенеца през 1903 г. в Декстър, Канзас, се получава незапалим газ. Първоначално не беше известно, че съдържа хелий. Кой газ е установено, идентифицирани състояние Еразъм Хауърт геолог, който е събрал своите проби и в университета в Канзас през химици Кейди Хамилтън и Дейвид Макфарланд установи, че тя съдържа 72% азот, 15% метан, 1% водород и 12% не е идентифициран. След допълнителен анализ изследователите установиха, че 1,84% от пробата е хелий. Така че ние знаем, че това химичен елемент присъства в големи количества в дълбините на Great Plains, където може да се извлича от природния газ.
Промишлено производство
Това прави Съединените щати световен лидер в производството на хелий. По предложение от сър Ричард Threlfall, военноморските сили на САЩ финансира три малък пилотен завод за производство на това вещество по време на Първата световна война, за да се гарантира, баража балони лек негорим вдигане на газ. За тази програма, общо 5700 м3 92 процента Той, въпреки че преди това са получени само по-малко от 100 литра газ. Част от този обем се използва в първия въздушен кораб на Хелий в света Американски флот C-7, който направи първия си полет от Хамптън Пътища (Вирджиния) в боллинг поле (Вашингтон, DC) 7 декември 1921 г.
Въпреки че процесът на втечняване на газ при ниски температури по това време не беше достатъчно развит, за да се окаже значим по време на Първата световна война, производството продължи. Хелият се използва главно като повдигащ газ в самолетите. Търсенето за това се е увеличило по време на Втората световна война, когато започна да се използва за заваряване с екраниран дъга. Елементът също беше важен в проекта за създаване на атомна бомба "Манхатън".

Национален резерв на САЩ
През 1925 г. правителството на САЩ е създаден Национален резерв на хелий в Амарило, Тексас, за да осигури военни дирижабли по време на война и търговски дирижабли в мирно време. Използването на газ падна след Втората света, но на запасите бе увеличена през 1950 г., за да се осигури, наред с другите неща, тя доставя като охладител се използва в производството на кислород-водород гориво, по време на космическата надпревара и на Студената война. Използването на хелий в САЩ през 1965 г. е осем пъти по-голямо от потреблението на войни.
След приемането на закона за хелий през 1960 г. планинското бюро договори 5 частни предприятия, за да извлече елемент от природен газ. За тази програма е изграден 425-километров газопровод, който свързва тези централи с частично изтощено газово находище в близост до Амарило, Тексас. Хелиево-азотната смес беше изпомпана в подземното хранилище и остана там, докато беше необходимо.
До 1995 г. е събран запас от 1 милиард кубически метра, а националният резерв е 1,4 млрд. Долара, което накара Конгреса на САЩ да прекрати постепенното си изтегляне през 1996 г. След приемането през 1996 г. на Закона за приватизацията на хелий, Министерството на природните ресурси започна да ликвидира депозитаря през 2005 г.

Чистота и обеми на продукцията
Хелийът, произведен преди 1945 г., има чистота около 98%, а останалите 2% представляват азот, който е достатъчен за дирижабли. През 1945 г. се произвежда малко количество 99,9 процента газ за използване при дъгова заварка. До 1949 г. чистотата на получения елемент достига 99,995%.
През годините Съединените щати са произвели повече от 90% от световния търговски хелий. От 2004 г. тя се произвежда ежегодно на 140 милиона м3, 85% от които попадат в САЩ, 10% са произведени в Алжир, а останалите - в Русия и Полша. Основните източници на хелий в света са газовите полета на Тексас, Оклахома и Канзас.
Процесът на получаване
Хелий (чистота 98,2%) се изолира от природен газ чрез втечняване на други компоненти при ниски температури и при високи налягания. Адсорбцията на други газове от охладения активен въглен позволява постигането на чистота от 99,995%. Когато се втечнява въздух в голям мащаб, се получава малък обем хелий. От 900 тона въздух можете да получите около 3.17 кубически метра. м газ.

Области на приложение
Благородният газ намери приложение в различни области.
- Хелий, които свойства позволяват да се получи много ниска температура, се използва като охлаждащ агент в LHC, MRI свръхпроводим магнит апарати и ядрено-магнитен резонанс спектрометри, сателитна оборудване, както и за втечняването на кислород и водород в ракети "Apollo".
- Като инертен газ за заваряване на алуминий и други метали в производството на оптични влакна и полупроводници.
- Да се създава налягане в резервоарите за гориво на ракетните двигатели, особено тези, които работят с течен водород, тъй като само хелиевият газ запазва своето агрегатно състояние, когато водородът остане течен);
- He-Ne газови лазери Използва се за сканиране на баркодове в касиерите в супермаркетите.
- Хелио-йонният микроскоп ви дава възможност да получите по-добри изображения, отколкото електронни.
- Благодарение на високото пропускливостта на благороден газ се използва за тестване на течове, например в автомобилни климатични системи, както и много бързо пълнене на въздушната възглавница при сблъсък.
- Ниска плътност позволява запълване на декоративни сфери с хелий. Инертният газ заменя експлозивния водород във въздушните кораби и балоните. Например, в метеорологията, хелиевите топки се използват за повдигане на измервателните уреди.
- В криогенната технология той служи като охладител, тъй като температурата на този химичен елемент в течно състояние е най-ниската възможна.
- Хелият, чиито свойства му осигуряват ниска реактивност и разтворимост във вода (и кръв), в смес с кислород, е намерил приложение в респираторните състави за гмуркане и извършване на хазната работа.
- Метеоритите и скалите се анализират за съдържанието на този елемент, за да се определи тяхната възраст.
Хелий: свойства на елементите
Основните физически свойства на Него са следните:
- Атомен номер: 2.
- Относителна маса на атома на хелий: 4,0026.
- Точка на топене: не.
- Точка на кипене: -268,9 ° С.
- Плътност (1 atm, 0 ° С): 0.1785 g / р.
- Оксидационни състояния: 0.
 Атмосфера и химически състав на Слънцето: описание и структура
Атмосфера и химически състав на Слънцето: описание и структура Газът е ...? Свойства, характеристики, интересни факти
Газът е ...? Свойства, характеристики, интересни факти Мога ли да направя хелий за топки у дома?
Мога ли да направя хелий за топки у дома? Редица метални дейности като израз на основните свойства на тези елементи
Редица метални дейности като израз на основните свойства на тези елементи Как да определите дали Слънцето е планета или звезда?
Как да определите дали Слънцето е планета или звезда? Точката на кипене на водата. Невероятни свойства на познато вещество
Точката на кипене на водата. Невероятни свойства на познато вещество Температурата на течния азот
Температурата на течния азот Solar Corona: описание, функции, яркост и интересни факти
Solar Corona: описание, функции, яркост и интересни факти Азотът е ли това? Видове и свойства на азота
Азотът е ли това? Видове и свойства на азота Какво е азот? Масата на азота. Азотна молекула
Какво е азот? Масата на азота. Азотна молекула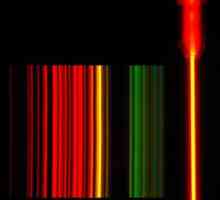 Какво представлява неонът? Химични и физични свойства на неоната, приложение
Какво представлява неонът? Химични и физични свойства на неоната, приложение Аргонът е специален елемент на периодичната таблица
Аргонът е специален елемент на периодичната таблица Експлозивната граница на природния газ. Физични свойства на газа
Експлозивната граница на природния газ. Физични свойства на газа Течен водород: свойства и приложения
Течен водород: свойства и приложения Течен хелий: характеристики и свойства на материята
Течен хелий: характеристики и свойства на материята Инертните газове са общи понятия, свойства и приложения
Инертните газове са общи понятия, свойства и приложения Структурата на слънчевата система
Структурата на слънчевата система Плътност на азота
Плътност на азота Метален водород
Метален водород Какво представлява натриев хидроген сулфат?
Какво представлява натриев хидроген сулфат? Точката на замръзване на водата е ???
Точката на замръзване на водата е ???