Закон за еквивалентността
The Great речник на думата еквивалент (на латински звучи като aequivalens) обяснява как нещо еквивалентно или негов еквивалент е еквивалент в друга, че лесно може да се замени. В химията, правото на еквиваленти (използван от края на 18 век, по който се преподава в училище, прилага химици и биолози от различни страни на теория и на практика) се посочва, че всички химикали реагират, пропорционално на техните еквиваленти. Законът беше открит от германския химик IV Richter, чиито творби отдавна не са били известни. В три обем работа публикувани в периода от 1792 до 1794 година, озаглавен "Принципи на стехиометрия, или метод за измерване на химичните елементи", Academic показано, че химикалите реагират просто съотношение. Той също така въведе термин като "стехиометрия". Сега това е цялата част от химията, която описва съотношението на реактивите, влизащи в химическо взаимодействие.
Рихтер е първият в своите трудове, цитирайки количествени реакционни уравнения. Те са условно вписване, съдържащо качествена и количествена информация за процесите, протичащи по време на взаимодействието на различни химикали, наречени реагенти. Дори по време на алхимичната наука учените използват различни символи, за да проектират прости елементи, а по-късно са открити формулите на комплексни химични вещества (състоящи се от няколко елемента). Но само IV Рихтер (под влияние на неговия учител и философ Имануел Кант, твърди, че някои области на естествените науки съдържат като много вярно науката като тя съдържа математика), използвани в тезата на химичните формули и терминът "стехиометрията", той описва количествена реакция уравнение и отвори право еквивалента. Формулата, той изрази може да се запише: E2 • m1 = E1 • m2. Когато М1 и М2 - тегло вещества е "1" и "2", нереагирал, и А1 и А2 - е техните химични еквиваленти.
За да се разбере право еквивалента, е необходимо да се уточни, че еквивалентни - е конвенционален реално число или вещество, което може да се приложи на водороден катион в киселинно-алкална реакция или електрона в резултат на редокси реакции. Еквивалентната маса е масата на един еквивалент. Смята се, че един еквивалент реагира вещество (или измества) с 1 грам от водород или кислород с 8 грама или 35.5 г хлор. На практика количеството на веществото в еквивалента често има много малка стойност, така че е обичайно да се изрази в молове. В един мол съдържа постоянно количество от частици (атоми, йони или молекули) е равен на броя Авагадро: НС = 6,02214179 (30) middot-1023. Масата на един мол вещество, изразена в грамове, е цифрово равна на неговата маса в атомни единици на маса.
Въз основа на Закона за еквивалентите може да се твърди, че с титруване на киселинната основа продължава реакция уравнение: КОН + HCl → KCl + H2O, резултат от взаимодействието на 1 мол калиев хидроксид с 1 мол солна киселина, се получава 1 мол сол, наречена калиев хлорид, и 1 мол вода. Това означава, че еквивалентното тегло на калиев хидроксид се равнява E КОН = 39 + 16 + 1 = 56грама солна киселина - Е HCl = 1 + 35 = 36гр, калиев хлорид - Е KCl = 39 + 35 = 74 гр, вода - Е H2O = • 2 1 + 16 = 18 за да може напълно да неутрализира 56 гр калиев хидроксид, необходима за 36 грама на солна киселина. Резултатът е 74 g калиев хлорид и 18 g вода. Но тъй като в закона, че веществата, теглото, нереагирал пропорционални на техните еквиваленти, а след това да знаят размера на реагент може да се изчисли колко ще влезе в реакцията или втория реактив за изчисляване на доходността на продукта.
Например, колко ще го направи калиев хлорид, ако е известно, че 100 g калиев хидроксид е напълно неутрализиран със солна киселина? Използване на закона на еквиваленти, могат да бъдат написани: 56 • mKCl = 74 • 100. Тогава mKCl = (74 • 100) / 56 = 132 А на солна киселина за неутрализиране на калиев хидроксид изисква 100 64 100 Ако град г калиев хидроксид за неутрализиране на сярната киселина: 2KOH + H2SO4 → K2SO4 + 2H2O, тогава това изисква напълно различно количество киселина. Както е посочено от стехиометрични коефициенти на тази реакция, 2 мола калиев хидроксид реагират 1 мол сярна киселина и резултатът е 1 мол калиев сулфат и 2 мола вода. Знаейки това, може да се напише тегло на нереагиралите вещества пропорционални еквивалентни тегла: 2 • 56 • 98 • MH2SO4 = 100, след това 100 за неутрализиране на калиев хидроксид MH2SO4 = 88 грама на сярна киселина. В този случай 155 g калиев сулфат. Количеството вода, освободено в резултат на неутрализирането на 100 g калиев хидроксид със солна киселина или сярна киселина, ще бъде същото и ще бъде равно на 32 g.
Отнася еквивалента Закона химия (аналитична, неорганична, органична и т.н.) за учебни материали и други експерименти въз основа на изчислението на остатъка от химични реакции. Освен това се използва (за съставяне на материални баланси) при проектирането и експлоатацията на лабораторни, пилотни или промишлени инсталации, предназначени за синтез на химикали. Те постоянно използват специалистите на химически, медицински, биологични, санитарно-епидемиологични лаборатории, тъй като тя е в основата на формулите, в който изчисляването на много резултати от тестовете.
 Моларна маса на кислорода. Каква е моларната маса на кислорода?
Моларна маса на кислорода. Каква е моларната маса на кислорода? Всичко за това, което WMZ е в "Webmani"
Всичко за това, което WMZ е в "Webmani" В търсене на професия: професии, свързани с химията
В търсене на професия: професии, свързани с химията Концентрация на разтвори
Концентрация на разтвори Историята на химията е кратка: описание, появяване и развитие. Кратка скица на историята на…
Историята на химията е кратка: описание, появяване и развитие. Кратка скица на историята на… Какъв е еквивалентът на TNT? Ядрена експлозивна енергия
Какъв е еквивалентът на TNT? Ядрена експлозивна енергия Известни руски химици, техния принос в науката
Известни руски химици, техния принос в науката Основни теми на теорията на Булеров АМ Основни теми на теорията за химическата структура на Булеров
Основни теми на теорията на Булеров АМ Основни теми на теорията за химическата структура на Булеров Какво прави химикът?
Какво прави химикът? Методи на титриметричен анализ. Типове титриране. Аналитична химия
Методи на титриметричен анализ. Типове титриране. Аналитична химия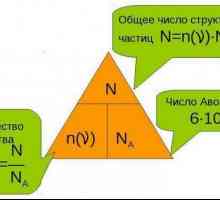 Какъв е размерът на материята и как се определя?
Какъв е размерът на материята и как се определя? Какво е молец в химията? Дефиниция и формули
Какво е молец в химията? Дефиниция и формули Как да съставяме химическо уравнение: правила, примери. Запис на химическата реакция
Как да съставяме химическо уравнение: правила, примери. Запис на химическата реакция Периодичната система на Менделеев и периодичното право
Периодичната система на Менделеев и периодичното право Известни химици: биографии и постижения
Известни химици: биографии и постижения Същността на химическата реакция. Законът за опазване на масови вещества (химия)
Същността на химическата реакция. Законът за опазване на масови вещества (химия) Пари и парични еквиваленти: значението на концепцията, структурата и представянето
Пари и парични еквиваленти: значението на концепцията, структурата и представянето Значението на думата "адекватно": смисъл, синоними и примери
Значението на думата "адекватно": смисъл, синоними и примери Първият и вторият закон на Фарадей
Първият и вторият закон на Фарадей Моларната маса на еквивалента
Моларната маса на еквивалента Моларна маса? Таблица за помощ!
Моларна маса? Таблица за помощ!