Фактори, определящи разтворимостта на протеините. Физикохимични свойства на протеините
Нашата статия ще бъде посветена на изучаването на свойствата на веществата, които са в основата на феномена на живота на Земята. Протеиновите молекули присъстват в не-клетъчни форми - вируси, са част от цитоплазмата и органоидите на прокариотните и ядрените клетки. Наред с нуклеиновите киселини те образуват вещество на наследственост - хроматин и образуват основните компоненти на ядрото - хромозомата. Сигналът, конструкцията, каталитичната, защитна енергия е списък на биологичните функции, които протеините изпълняват. Физикохимичните свойства на протеините са тяхната способност да се разтварят, утаяват се и се осоляват. В допълнение, те могат да денатурират и поради химичната им природа са амфотерни съединения. Нека по-нататък изучаваме тези свойства на протеините.
съдържание
- Видове протеинови мономери
- Какви фактори влияят на разтворимостта на пептидите?
- Глобули и способността им да се хидратират
- Фибрилни пептиди
- Кератин и характеристиките на тяхната структура
- Ефект на рН на средата върху заряда на протеиновия полимер
- Фактори, определящи разтворимостта на протеините
- Поведение на протеините в електрическо поле
- Как разтворимостта на протеина влияе върху концентрацията на солите
- Осоляване
- Утаяване и денатуриране

Видове протеинови мономери
20 вида алфа-аминокиселините са структурните единици на протеина. В допълнение към въглеводородния радикал, те съдържат NH2- амино група и СООН-карбоксилна група. Функционалните групи определят киселинните и основни свойства мономери на протеини. Следователно, в органичната химия, съединения от този клас се наричат амфотерни вещества. Водородните йони на карбоксилната група в молекулата могат да бъдат разцепени и свързани към аминогрупи. В резултат на това се образува вътрешната сол. Ако в молекулата присъстват няколко карбоксилни групи, съединението ще бъде кисело като глутаминова киселина или аспарагинова киселина. Ако аминогрупите преобладават, аминокиселините са основни (хистидин, лизин, аргинин). При еднакъв брой функционални групи пептидният разтвор има неутрална реакция. Установено е, че наличието на трите вида аминокиселини влияе върху това, което знаците ще имат протеини. Физико-химичните свойства на протеините: разтворимост, индекс на водород, заряд на макромолекула, се определят от съотношението на киселинни и основни аминокиселини.
Какви фактори влияят на разтворимостта на пептидите?
Ще изясним всички необходими критерии, които зависят от процесите на хидратация или солвация на макромолекули на протеини. Те са: пространствена конфигурация и молекулно тегло, определени от броя на аминокиселинните остатъци. Той взема предвид и съотношението на полярните и неполярни части - радикали, разположени на повърхността на протеина в третичната структура и общия обем на полипептидната макромолекула. Всички от горните свойства пряко засягат разтворимостта на протеина. Нека ги разгледаме по-подробно.

Глобули и способността им да се хидратират
Ако външната структура на пептида е сферична, тогава е обичайно да се говори за неговата глобуларна структура. Стабилизира се от водородни и хидрофобни връзки, както и от силите на електростатично привличане на хетерогенно заредени части от макромолекулата. Например, хемоглобинът, който носи молекулата на кислорода през кръвта, в кватернерната форма се състои от четири фрагмента миоглобин, комбинирани с хема. Такива кръвни протеини, като албумини, алфа- и upsih-глобулини, лесно взаимодействат с вещества от кръвната плазма. Инсулинът е друг глобуларен пептид, който регулира нивото на глюкозата в кръвта на бозайниците и хората. Хидрофобни части от такива пептидни комплекси са в средата на компактна структура и хидрофилни части са разположени на повърхността му. Това гарантира, че те запазват своите естествени свойства в течната среда на организма и ги обединяват в група водоразтворими протеини. Изключението е глобуларните протеини, които образуват мозаичната структура на мембраните на човешки и животински клетки. Те са свързани с гликолипиди и неразтворими в междуклетъчната течност, което гарантира, че те изпълняват бариера в клетката.
Фибрилни пептиди
Колагенът и еластинът, които са част от дермата и причиняват неговата еластичност и еластичност, имат структура, подобна на нишката. Те са в състояние да се простират, променят своята пространствена конфигурация. Фиброинът е протеин от естествена коприна, произведен от ларви на копринената буба. Той съдържа къси структурни влакна, състоящи се от аминокиселини с малка маса и дължина на молекулата. Това са преди всичко серин, аланин и глицин. Нейните полипептидни вериги са ориентирани в пространството във вертикална и хоризонтална посока. Субстанцията принадлежи към структурните полипептиди и има слоеста форма. За разлика от глобуларните полипептиди, разтворимостта на протеина, състоящ се от фибрили, е много малка, тъй като хидрофобните радикали на неговите аминокиселини лежат на повърхността на макромолекулата и отблъскват полярните частици на разтворителя.

Кератин и характеристиките на тяхната структура
Като се има предвид групата на структурните фибриларни протеини форми, като фиброин и колаген, е необходимо да се спрем на една по-широко разпространена в естествената група пептиди - кератин. Те служат като основа за такива части на човешкото тяло и животни като косми, нокти, пера, вълна, копита и нокти. Какво представлява кератинът от гледна точка на неговата биохимична структура? Установено е, че има два вида пептиди. Първият има формата на спирална вторична структура (алфа-кератин) и е основата на косата. Другият е представен от по-дълги пластови фибрили - това бета - кератин. Той може да се намери в твърдите части на тялото на животни: копитата, човката на птиците, везни от влечуги, нокти на хищни бозайници и птици. Какво е кератин, въз основа на факта, че неговите аминокиселини, например валин, фенилаланин, изолевцин, съдържат голям брой хидрофобни радикали? Това е протеин, неразтворим във вода и други полярни разтворители, изпълняващ защитна и структурна функция.
Ефект на рН на средата върху заряда на протеиновия полимер
По-рано споменахме, че функционалните групи на протеиновите мономери - аминокиселини, определят техните свойства. Сега добавяме, че полимерният заряд също зависи от тях. Йоногенни радикали - карбоксилните групи на глутаминова и аспарагинова киселина и аминогрупата на аргинин и хистидин влияят върху общия заряд на полимера. Те също се държат по различен начин в кисела, неутрална или алкална среда. Разтворимостта на протеина също зависи от тези фактори. Така, при рН<7, разтворът съдържа прекомерна концентрация на водородни протони, които инхибират разграждането на карбоксил, така че общият положителен заряд на протеиновата молекула се увеличава.

Натрупването на катиони в протеина също се увеличава в случая на среда на неутрален разтвор и с излишък от мономери на аргинин, хистидин и лизин. В алкална среда се наблюдава увеличение на отрицателния заряд на полипептидната молекула, тъй като излишък от водородни йони се изразходва за образуването на водни молекули чрез свързване на хидроксилни групи.
Фактори, определящи разтворимостта на протеините
Нека си представим ситуация, при която броят на положителните и отрицателните натоварвания на протеинова спирала е еднакъв. РН на средата в този случай се нарича изоелектрична точка. Общият заряд на макромолекулата на самия пептид става нула и неговата разтворимост във вода или друг полярен разтворител ще бъде минимална. Позициите на теорията за електролитната дисоциация сочат това разтворимостта на материята в полярен разтворител, състоящ се от диполи, толкова по-висока ще бъде поляризирането на частиците на разтворимото съединение. Те също така обясняват факторите, които определят разтворимостта на протеините: тяхната изоелектрична точка и зависимостта от хидратацията или солвацията на пептида върху общия заряд на неговата макромолекула. Повечето полимери от този клас съдържат излишък от -COO- и имат леко киселинни свойства. Изключението ще бъде споменатото по-горе мембранни протеини и пептидите, които съставляват ядрената субстанция на наследствеността, са хроматин. Последните се наричат хистони и имат изразени основни свойства поради наличието на голям брой аминогрупи в полимерната верига.

Поведение на протеините в електрическо поле
За практически цели често е необходимо да се отделят, например, кръвните протеини, във фракции или индивидуални макромолекули. За тази цел може да се използва способността на заредените полимерни молекули да се движат с определена скорост на електродите в електрическо поле. Разтвор, съдържащ различни масови и зареждащи пептиди, се поставя върху носител: хартия или специален гел. Чрез преминаване на електрически импулси, например чрез част от кръвната плазма, се получават до 18 фракции от отделни протеини. Сред тях всички видове глобулин и албумин протеин, който е не само основна съставка компонент (което представлява 60% от масата на пептидите от кръвна плазма), но също така играят централна роля в процесите на осмоза и кръвообращението.
Как разтворимостта на протеина влияе върху концентрацията на солите
Способността на пептидите да образуват не само гелове, пени и емулсии, но и разтвори е важно свойство, което отразява техните физикохимични характеристики. Например изследваните преди това албузини в ендоспермата на зърнените семена, млякото и серума бързо образуват водни разтвори с концентрация на неутрални соли, например, като натриев хлорид, в диапазона от 3 до 10%. На примера на същите албумини зависимостта на разтворимостта на протеина от концентрацията на солта може да бъде определена. Те се разтварят добре в ненаситения разтвор на амониев сулфат, а в свръхнаситен разтвор те се образуват обратимо и когато концентрацията на солта се намалява допълнително чрез добавяне на част от водата, те възстановяват своята хидратирана черупка.

Осоляване
Гореописаните химични реакции на пептиди с разтвори на соли, образувани от силна киселина и алкали, се наричат изсолване. Тя се основава на механизма на взаимодействие на заредените функционални групи протеини със солеви йони - метални катиони и аниони на киселинни остатъци. Той завършва със загуба на заряд върху пептидната молекула, понижаване на нейната обвивка с вода, сгъстяване на протеиновите частици. В резултат на това се случва тяхното отлагане, на което ще продължим да живеем.
Утаяване и денатуриране
Ацетонът и етиловият алкохол унищожават обвивката на водата около протеина в третичната структура. Това обаче не е придружено от неутрализиране на общата сума на таксата. Такъв процес се нарича утаяване, разтворимостта на протеина се намалява рязко, но не завършва с денатуриране.

Молекулите на пептидите в естественото състояние са много чувствителни към много параметри на външната среда, например до температурата и концентрацията на химичните съединения: соли, киселини или алкали. Укрепването на ефекта и на двата фактора в изоелектричната точка води до пълното унищожаване на стабилизиращите вътрешномолекулни (дисулфидни мостове, пептидни връзки), ковалентни и водородни връзки в полипептида. Особено бързо в такива условия денатурират глобуларни пептиди, като напълно губят своите физико-химични и биологични свойства.
 Клетъчни органоиди и техните функции: разнообразие, функции и свойства
Клетъчни органоиди и техните функции: разнообразие, функции и свойства Какви прости органични съединения са протеините? Структура и свойства на функциите
Какви прости органични съединения са протеините? Структура и свойства на функциите Физични свойства на протеините. Най-важните химични свойства на протеините
Физични свойства на протеините. Най-важните химични свойства на протеините Протеин: какво е и какво е необходимо за тялото?
Протеин: какво е и какво е необходимо за тялото? Структурата на еукариотната клетка
Структурата на еукариотната клетка Биополимерите са ... Растителни полимери
Биополимерите са ... Растителни полимери Протеини: Протеинова структура и функция
Протеини: Протеинова структура и функция Каталитичната функция на протеините: примери. Основните функции на протеините
Каталитичната функция на протеините: примери. Основните функции на протеините Мономерите на протеините са какви вещества? Какво представляват протеиновите мономери?
Мономерите на протеините са какви вещества? Какво представляват протеиновите мономери? Протеини: класификация на протеините, структура и функции
Протеини: класификация на протеините, структура и функции Протеин с кватернерна структура: Характеристики на структурата и функционирането
Протеин с кватернерна структура: Характеристики на структурата и функционирането Каква е функцията на протеините?
Каква е функцията на протеините? Защитна функция на протеините. Структура и функция на протеините
Защитна функция на протеините. Структура и функция на протеините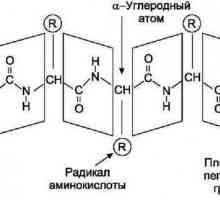 От молекулите на аминокиселинните остатъци на това, което се изгражда?
От молекулите на аминокиселинните остатъци на това, което се изгражда? От какво се състои протеинът? Примери за прости и сложни протеини
От какво се състои протеинът? Примери за прости и сложни протеини Структурата на аминокиселините. Определяне и класификация на аминокиселини
Структурата на аминокиселините. Определяне и класификация на аминокиселини Фибриларен и глобулиран протеин, протеинов мономер, модели на протеинов синтез
Фибриларен и глобулиран протеин, протеинов мономер, модели на протеинов синтез Всеобщият генетичен код
Всеобщият генетичен код Химически състав на клетката
Химически състав на клетката Синтез на протеин
Синтез на протеин Най-големите клетки от органична материя
Най-големите клетки от органична материя