Радикалът в химията е какво? Теория на радикалите в химията
Радикалите в химията са атомни частици, които имат някои особености, свързани с прехода между съединенията. В тази статия ще се запознаем с представителите на радикалите, техните дефиниции и особености, а също така ще обърнем внимание на видовото разнообразие.
съдържание
въведение
Радикалът в химията е атомът или неговата група, които могат да преминат, без да преминават през промени, от една комбинация от връзка към друга. Подобна дефиниция беше използвана от AL Lavoisier, който я създаде.

Според Лавоазие се приема, че всяка киселина се образува от две прости и неразтворими вещества - кислород и киселинен радикал. Според тази гледна точка се приема, че сярна киселина се създава от кислород и сяра. Въпреки това, в тези дни все още не е известно разликата между киселинен анхидрид и самата киселина.
Създаване на теория
Теорията за радикалите в химията е една от водещите в химията през първата половина на XIX век. Основава се на идеята на AL Lavoisier за значението на кислородните атоми в химическата доктрина и на дуалистичната форма на химията. съединения. Той, използвайки "радикала" като терминологична единица, изрази мислите си. Те засягат структурните характеристики на органичните и неорганичните киселини. Последните, по негово мнение, са били образувани от кислород и обикновени радикали (от първия елемент). Органичните киселини са вещества, комбинирани от взаимодействието на О2 и комплексни радикали (съединение С и Н).
След откриването на цианоген и аналогия между някои цианиди и хлориди, разбирането на сложните радикали се подобри и засили. Те започнаха да се дефинират като атоми, които не се променят по време на прехода от първото до второто. I.Bartselitsus подкрепи това мнение с авторитетно мнение. Друга важна стъпка към разбирането на тези вещества беше предложението да се разгледа алкохолът от вината и етер като естер хидрат. Тази гледна точка е приета от г-н Дюма и П. Бул.

Радикалите в химията са вещества, които не претърпяват промени по време на прехода. Теорията, създадена за тяхното описание в годините 1840-50, постепенно започва да се заменя с теорията на типовете. Промяната се дължи на наличието на значителен брой фактори, които бяха противоречиво описани от TR.
Организъм и радикали
Свободните радикали в организма са частици, които имат един или повече недвни електрони, разположени върху външната обвивка на електроните. В друга дефиниция свободният радикал е описан като молекула или атом, способен да поддържа самостоятелно съществуване. Той има известна стабилност и 1 - 2 електрона (напр-) в неподвоено състояние. Частиците е- заемат орбитал на молекула или атом в една форма. Радикалите се характеризират с наличието на парамагнитни свойства, което се обяснява с взаимодействието на електрона с магнитните полета. Има случаи, при които наличието на е- в ненасочена форма води до значително повишаване на реактивността.
Примери за свободни радикали са кислородните молекули (О.2), азотен оксид с различна валентност (NO и NO2) и хлорен диоксид (ClO2).

органика
Органичните радикали са йонни частици, които се характеризират едновременно с наличието на недвоен електронен и заряд. Най-често в реакциите на органичната химия се създават йонни радикали в резултат на потока на един-електронен трансфер.
Ако окисляването протича в една електронна форма и е приложимо за неутрална молекула с излишък от електронна плътност, тя ще доведе до образуването на радикален катион. Обратният ход на процеса, по време на който неутралната молекула се възстановява, води до образуването на анионен радикал.
Редица ароматни въглеводороди от многоядрена група могат независимо да образуват двата вида радикални йони (органични) без много усилия.

Свободните радикали в химията са изключително разнообразни вещества, както в тяхната структура, така и в свойствата. Те могат да останат в различни агрегатни състояния, например течност или газ. Също така, продължителността на живота им или броят на електроните, които остават непроменени, може да се различават. Обикновено всеки радикал може да бъде причислен към една от двете групи: -p- или s-electronic. Те се различават по местонахождението на несдвоените e-. В първия случай, отрицателната частица заема 2p орбитална позиция в преобладаващия брой случаи. Съответният ред от атомни ядра е в възловата орбитална равнина. Във варианта със s-групата локализацията на електрона се извършва по такъв начин, че нарушението на електронната конфигурация на практика не се случва.

Понятието за въглеводороден радикал
Въглеводородният радикал е атомна група, която образува връзка с молекулярна функционална група. Те също така се наричат остатъци от въглеводороди. Най-често по време на химията. реакционните радикали преминават преход от едно съединение към друго и не се променят. Въпреки това, такива обекти на химическо изследване могат да носят редица функционални групи. Разбирането на това прави човек по-внимателно да се държи с радикалите. Тези съединения са по-често вещества, които съдържат въглеводородни остатъци. Самият радикал може да бъде функционална група.
Феноменът на алкилите
Алкиловите радикали са съединения от редица междинни съединения, които са частици от алкани. Те имат свободно- в единствено число. Пример за това е метил (СН3) и етил (С2Н5). Сред тях се различават няколко типа: първични (например, метил - СН3), вторичен (изопропил -> CH (CH3)2), третичен (трет-бутил-С (СН3)3) и кватернерни (неопентил-СН2C (CH3)3) група алкилови радикали.

Феноменът в метилен
Метиленовият радикал е най-простата форма на карбен. Представено е като безцветен газ и формулата е подобна на въглеводородите от серия от алкени - CH2. Предположението за съществуването на хлорид е направена през тридесетте години на ХХ век, но да се намери неопровержими доказателства е само през 1959 г. Това беше направено чрез спектрален изследователски метод.
Производството на метилен е възможно благодарение на използването на диазометан или кетанови вещества. Те се подлагат на разлагане под въздействието на ултравиолетовите лъчи. В този процес се образува метилен, както и азотни молекули и въглероден монооксид.
Радикалът в химията също е метиленова молекула, която има един въглероден атом, в който няма двойна връзка. Това отличава метилен от алкени и поради това се класифицира като карбен. Той се характеризира с екстремна химическа активност. Позицията на електроните може да причини различни свойства на химически характер и геометрия. Има синглет (напр- - свързани) и триплет (електрон, оставащ в свободно състояние - несвързан) форма. Триплетната форма дава възможност да се опише метилен като бирадикал.
hydrophoby

Хидрофобен радикал е съединение, имащо различна полярна група. Такива молекули и атоми могат да влязат в контакт с аминоалкилсулфо групи чрез различни междинни връзки.
Съгласно структурата са изолирани радикали с права и разклонена верига, парафин (олефин) и перфлуорирани. Наличието на хидрофобен радикал позволява на някои вещества лесно да проникнат в двойните липидни мембрани и също така да бъдат вградени в техните структури. Такива вещества са част от неполярни аминокиселини, които се освобождават благодарение на определен индикатор за полярността на страничната верига.
В настоящия метод, рационални класификация амино радикали разделят според тяхната полярност, т.е.. Е. способността да реагира с вода в присъствието на физиологичен значение рН (около 7.0 рН). В съответствие с типа, съдържащ радикал идентифицира няколко класа аминокиселинни: неполярен, полярен, ароматна отрицателно и положително заредена група.
Радикалите с хидрофобни свойства причиняват общо намаляване на разтворимостта на пептидите. Аналози с хидрофилни качествени характеристики причиняват образуването на хидратна обвивка около самата аминокиселина и пептидите се разтварят по-добре при взаимодействие с тях.
 Кои са радикалите? Радикалите на Русия и Украйна, кои са те?
Кои са радикалите? Радикалите на Русия и Украйна, кои са те? Една порутена фраза: "Какво е радикал?"
Една порутена фраза: "Какво е радикал?" Нишесте: формула, свойства и много други
Нишесте: формула, свойства и много други Сярна киселина. Формула, свойства, производство и приложение
Сярна киселина. Формула, свойства, производство и приложение Натриев карбонат, натриев хидрогенкарбонат - най-интересното
Натриев карбонат, натриев хидрогенкарбонат - най-интересното Едно вещество в химията е какво? Свойства на веществата. Класове вещества
Едно вещество в химията е какво? Свойства на веществата. Класове вещества Какво прави химикът?
Какво прави химикът? Колко полезна е химията за дълга коса?
Колко полезна е химията за дълга коса?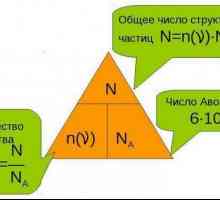 Какъв е размерът на материята и как се определя?
Какъв е размерът на материята и как се определя? Какво е молец в химията? Дефиниция и формули
Какво е молец в химията? Дефиниция и формули Какъв е показателят в химията: определението, примерите, принципът на действие
Какъв е показателят в химията: определението, примерите, принципът на действие Закон за еквивалентността
Закон за еквивалентността Какво представлява полимеризацията в органичната химия
Какво представлява полимеризацията в органичната химия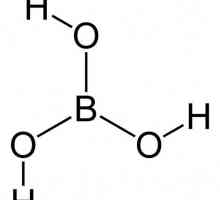 Формулата на борна киселина в химията
Формулата на борна киселина в химията Същността на химическата реакция. Законът за опазване на масови вещества (химия)
Същността на химическата реакция. Законът за опазване на масови вещества (химия) Основни закони на химията
Основни закони на химията Оцетен анхидрид: свойства, производство и приложение
Оцетен анхидрид: свойства, производство и приложение Основи на химията: свойства, приложение и производство на азот
Основи на химията: свойства, приложение и производство на азот Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията
Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията Химията е вълнуваща!
Химията е вълнуваща!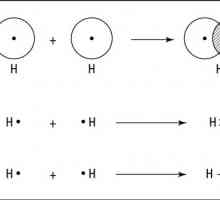 Предметът и задачите на химията. Обща химия. Органична химия
Предметът и задачите на химията. Обща химия. Органична химия