Амонячна вода: препарат, формула, приложение
Безцветен газ с остър мирис на амоняк NH3
съдържание
Образуване на амониеви йони
 Формула на амонячната вода - NH4ОН. Веществото съдържа NH катион4+, който се образува от неметални - азот и водород. Атомите N в амонячна молекула се използват за образуване ковалентни полярни връзки само 3 от 5 външни електрона, а една двойка остава непотърсена. В силно поляризирана водна молекула, водородните протони Н+ са слабо свързани към кислорода, единият от тях става донор на свободна електронна двойка азот (акцептор).
Формула на амонячната вода - NH4ОН. Веществото съдържа NH катион4+, който се образува от неметални - азот и водород. Атомите N в амонячна молекула се използват за образуване ковалентни полярни връзки само 3 от 5 външни електрона, а една двойка остава непотърсена. В силно поляризирана водна молекула, водородните протони Н+ са слабо свързани към кислорода, единият от тях става донор на свободна електронна двойка азот (акцептор).
Получава се амониев йон с един положителен заряд и специален тип слаба ковалентна връзка - донор-акцептор. Според размера, заряда и някои други характеристики, тя прилича на калиев катион и се държи така алкални метали. Необичайно химично, съединението реагира с киселини, образува соли, които са от голямо практическо значение. Наименования, в които се отразяват характеристиките на препарата и свойствата на веществото:
- амонячна вода;
- амониев хидроксид;
- хидрат на амоняк;
- акрил амоний.
обезпечителни мерки
При работа с амоняк и неговите производни трябва да се внимава. Важно е да запомните:
- Амониевата вода има неприятна миризма. Освободеният газ дразни лигавицата на носната кухина, окото, причинява кашлица.
- Когато се съхранява амоняк в плътно затворени бутилки ампулите се разпределят с амоняк.
- Можете да откривате без уреди, само с мирис, дори малко количество газ в разтвора и въздуха.
- Съотношението между молекулите и катионите в разтвора варира при различно рН.
- При стойност от около 7, концентрацията на токсичен газ NH3, количеството NH катиони, което е по-малко вредно за живите организми, се увеличава4+
Приготвяне на амониев хидроксид. Физични свойства

Когато амонякът се разтваря във вода, образува се амонячна вода. Формулата за това вещество е NH4OH, но всъщност има едновременно йони
NH4+, OH-, NH молекули3 и H2О. В химическата реакция на йонообмен между амоняк и вода се установява равновесно състояние. Процесът може да се отрази чрез схема, в която противоположно насочени стрелки показват обратимостта на явленията.
В лабораторията производството на амонячна вода се извършва в експерименти с азотсъдържащи вещества. При смесване на амоняк с вода се получава бистра, безцветна течност. При високо налягане се увеличава разтворимостта на газа. Водата дава повече разтворен амоняк, когато температурата се повиши. За промишлени нужди и земеделие в промишлен мащаб се получава 25% вещество при разтварянето на амоняка. Вторият метод включва използването на реакция кокс газ с вода.
Химични свойства на амониев хидроксид
При контакт, две течности - амонячна вода и солна киселина - са покрити с облаци бял дим. Състои се от частици от реакционния продукт - амониев хлорид. С летлива субстанция, като например солна киселина, реакцията протича директно във въздуха.

Слабо алкални химични свойства на амониевия хидрат:
- Веществото обратимо дисоциира във вода, за да образува амониев катион и хидроксиден йон.
- В присъствието на NH4+ безцветен разтвор на фенолфталеин се превръща в пурпурен цвят, както при алкали.
- химически реакция на неутрализация с киселини води до образуването на амониеви соли и вода: NH4ОН + НС1 = NH4Cl + H2О.
- Амонячната вода влиза в йонообменни реакции с метални соли, към които отговарят слабите основи, докато се образува водонеразтворим хидроксид: 2NH4OH + CuCl2 = 2NH4Cl + Cu (OH)2 (синя утайка).
Амонячна вода: приложение в различни отрасли на икономиката
Необичайно вещество се използва широко в ежедневието, селското стопанство, медицината, промишлеността. Техническият амониев хидрат се използва в селското стопанство, производството на калцинирана сода, бои и други продукти. В течния тор азотът се съдържа във форма, лесно асимилирана от растения. Веществото се счита за най-евтино и най-ефективно за прилагане в периода на удължаване за всички култури.

Производството на амонячна вода консумира три пъти по-малко средства, отколкото за производството на твърди гранулирани азотни торове. За съхранение и транспортиране на течности се използват херметично запечатани стоманени резервоари. Някои видове бои и избелващи средства за коса се изработват с каустик амоний. Във всяка медицинска институция има лекарства с амониев алкохол - 10-процентов разтвор на амоняк.
Амониеви соли: свойства и практическа значимост

Веществата, получени от взаимодействието на амониев хидроксид с киселини, се използват в икономическите дейности. Солите се разпадат при нагряване, разтварят се във вода, претърпят хидролиза. Те влизат в химични реакции с алкали и други вещества. Най - важното практическо значение са получени от хлориди, нитрати, сулфати, фосфати и амониеви карбонати.
Много е важно да спазвате правилата и мерките за безопасност, като работите с вещества, съдържащи амониев йон. Когато се съхраняват в складове на промишлени и селскостопански предприятия, в помощни стопанства не трябва да има контакт на такива съединения с вар и алкали. Ако непропускливостта на опаковките е нарушена, химичната реакция ще започне с освобождаването на токсичния газ. Всеки, който трябва да работи с амонячна вода и нейните соли, трябва да познава основите на химията. Ако са изпълнени изискванията за безопасност, използваните вещества няма да навредят на хората и околната среда.
 Молекула на водорода: диаметър, формула, структура. Каква е масата на молекулата на водорода?
Молекула на водорода: диаметър, формула, структура. Каква е масата на молекулата на водорода?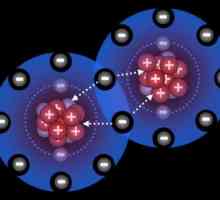 Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор?
Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор? Какво представлява сложно вещество? Как се случва това?
Какво представлява сложно вещество? Как се случва това?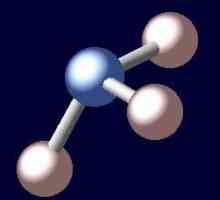 Амонякът е антипод и аналог на водата?
Амонякът е антипод и аналог на водата?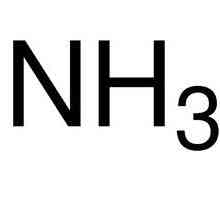 Определете валентността на химичните елементи
Определете валентността на химичните елементи Молекулярна и структурна формула на фенола
Молекулярна и структурна формула на фенола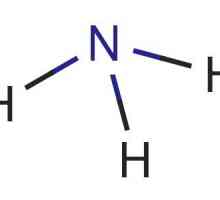 Формула на амоняка. Амониевият хидроксид е воден разтвор на амоняк
Формула на амоняка. Амониевият хидроксид е воден разтвор на амоняк Амоняк. Химични свойства, физични характеристики. Прилагане и приемане
Амоняк. Химични свойства, физични характеристики. Прилагане и приемане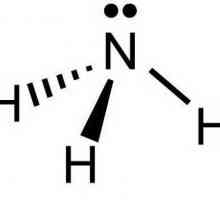 Какво представлява амонякът? Формула и свойства на амоняка
Какво представлява амонякът? Формула и свойства на амоняка Въглероден монооксид: Формула и свойства
Въглероден монооксид: Формула и свойства Сол. Амониев бикарбонат
Сол. Амониев бикарбонат Донор-акцепторна връзка: примери за вещества
Донор-акцепторна връзка: примери за вещества Как да определите степента на окисляване
Как да определите степента на окисляване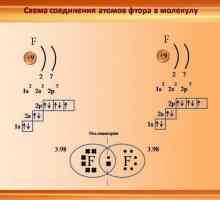 Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка
Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка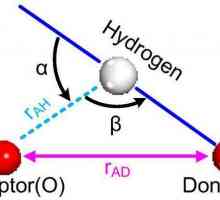 Водородна връзка: примери и видове химически връзки
Водородна връзка: примери и видове химически връзки Основните видове химически връзки: защо и как се формират
Основните видове химически връзки: защо и как се формират Какво представлява водородната връзка? Видове, влияние
Какво представлява водородната връзка? Видове, влияние Амониевият йон е донор-акцепторен взаимодействащ йон
Амониевият йон е донор-акцепторен взаимодействащ йон Моларна маса на амоняка, свойства, приложение
Моларна маса на амоняка, свойства, приложение Химичното равновесие е основата на обратимите химични реакции
Химичното равновесие е основата на обратимите химични реакции Химическа връзка: определение, видове, класификация и характеристики на определението
Химическа връзка: определение, видове, класификация и характеристики на определението