Структурна и молекулярна формула: ацетилен
Характеристиките на структурата на ацетилена оказват влияние върху неговите свойства, производство и приложение. Конвенционалното обозначение на веществото -2
съдържание
Алкини. Общата формула. ацетилен
Въглеводородите на алкина или ацетилена са ациклични, ненаситени. Веригата от въглеродни атоми не е затворена, има прости и многобройни връзки в нея. Съставът на алкините отразява обобщената формула СпН2n- 2. В молекулите на веществата от този клас има една или повече тройни връзки. Ацетиленовите съединения се отнасят до ненаситени съединения. Това означава, че само една валентност на въглерода се реализира благодарение на водорода. Останалите три връзки се използват при взаимодействие с други въглеродни атоми.
Първият - и най-известен представител на алкини - ацетилен или етин. Тривиалното наименование на веществото идва от латинската дума "ацетум" - "оцет" и гръцки - "хиле" - "дърво". Основателят на хомоложната серия е открит през 1836 година химични експерименти, По-късно веществото е синтезирано от въглища и водород от Е. Дейви и М. Берто (1862). При нормална температура и нормално атмосферно налягане ацетиленът е в газообразно състояние. Това е безцветен газ, без мирис, слабо разтворим във вода. Етинът е по-лесно разтворим в етанол и ацетон.

Молекулна формула на ацетилен
Етин - най-простият член на неговата хомоложна серия, нейният състав и структура отразяват формулите:
- C2Н2 - молекулярен запис на състава на етана, който дава представа, че веществото се образува от два въглеродни атома и един и същ брой водородни атоми. Съгласно тази формула е възможно да се изчислят молекулните и моларна маса връзка. (От2Н2) = 26 а. например, М (С.2Н2) = 26.04 g / mol.
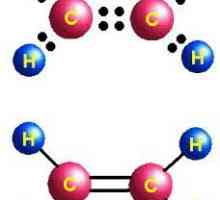
- Н: С ::: С: Н - формулата на електронната точка на ацетилен. Такива образи, наречени "структури на Луис", отразяват електронна структура молекула. При писането е необходимо да се спазват правилата: водородният атом има тенденция да има конфигурация на валентната черупка на хелий при образуването на химическа връзка, а останалите елементи - с октет от външни електрони. Всяко дебело черво означава общо за двата атома или неразделна двойка електрони на външното енергийно ниво.
- H-Cequiv-C-H е структурната формула на ацетилена, която отразява реда и множеството връзки между атомите. Едно тире замества една двойка електрони.

Модели на ацетиленовата молекула
Формули, показващи разпределението на електрони, служи като основа за създаването на атом-орбитални модели, пространствени формули на молекулите (стереохимични). Дори в края на XVIII век пролиферираха sharosterzhnevye модел - например топки от различни цветове и размери, показващи въглерод и водород, които образуват ацетилен. Структурната формула на молекулата е представена под формата на пръчки, които символизират химичните връзки и техния брой във всеки атом.

Сферичният модел на ацетилен възпроизвежда ъгли на валентност, равняващи се на 180 °, но вътрешноядрените разстояния в молекулата се отразяват приблизително. Празните между топките не създават картина на пълненето на пространството на атомите с електронна плътност. Недостатъкът се елиминира в моделите на Driding, които определят ядрата на атомите не с топки, а с точките на закрепване на пръчките един към друг. Модерни обемни модели дават по-ясна представа за атомните и молекулните орбитали.
Хибридни атомни орбитали на ацетилен
Въглеродът във възбудено състояние съдържа три p-орбитални и един s с недвоени електрони. При образуването на метан (CH4) те участват в създаването на еквивалентни връзки с водородни атоми. Известен американски изследовател Л. Полинг разработи теорията за хибридното състояние на атомните орбитали (АО). Обяснението на поведението на въглерода в химическите реакции е изравняването на АО във формата и енергията, образуването на нови облаци. Хибридните орбитали дават по-силни връзки, формулата става по-стабилна.
Въглеродните атоми в ацетиленовата молекула, за разлика от метана, преминават sp-хибридизация. S и p електроните се смесват във форма и енергия. Изглеждат две сп-орбитали, разположени под ъгъл от 180 °, насочени към противоположните страни на ядрото.

Тройна връзка
В ацетилен, хибридни електронни облаци от въглерод участват в създаването на сигма-връзки със същите съседни атоми и с водород в С-Н двойки. Остават два нехибридни р-орбита, перпендикулярни една на друга. В молекулата на етилена участват в образуването на две пи - ограничения. Заедно с sigma- има тройна връзка, която отразява структурната формула. Ацетиленът се различава от етан и етилен от разстоянието между атомите. Тройната връзка е по-къса от двойното, но има по-голям енергиен резерв, е по-солидна. Максимална плътност сигма ... и пи-връзки се намира в перпендикулярни области, което води до образуването на цилиндричен облак от електрони.
Характеристики на химичната връзка в ацетилен
Етиленовата молекула има линейна форма, която успешно отразява химичната формула на ацетилен - H-Cequiv-C-H. Атомите на въглерода и водорода са по права линия, 3 между тях сигма и 2 пи - връзка. Свободното движение, въртенето по оста C-C е невъзможно, което се предотвратява от наличието на множество връзки. Други характеристики на тройната връзка:
- броят на двойките електрони свързващи два въглеродни атома е 3;
- дължина - 0.120 nm;
- Енергията на разрушаване е 836 kJ / mol.
За сравнение: в молекулите на етан и етилен единична дължина и двойно химична връзка - 1.54 и 1.34 пМ, съответно, енергийната междина С-С е 348 кДж / мол, С = С - 614 кДж / мол.

Хомолози на ацетилен
Ацетиленът е най-простият представител на алкините, чиито молекули също имат тройна връзка. Propyn CH3Cequiv-CH е хомологът на ацетилена. Формула на третия представител на алкин-бутин-1-СН3СН2Sequiv-СН. Ацетиленът е тривиалното име на етана. Систематична номенклатура Alkines се подчинява на правилата на IUPAC:
- в линейни молекули посочва името на главната верига, която е резултат от гръцката числото, към който се добавя суфикс -В и атомен номер с тройна връзка, например етинил, пропинил, бутин-1;
- номерирането на основната верига от атоми започва в края на молекулата, най-близо до тройната връзка;
- за разклонени въглеводороди първо се следва наименованието на страничния клон, последвано от името на главната верига от атоми с наставката -in.
- крайната част на името - фигура, показваща местоположението на тройната връзка в молекулата, например бутин-2.

Изомеризъм на алкините. Зависимост на свойствата от структурата
Етинът и пропинът нямат изомери на позицията на тройната връзка, те се появяват като се започва с бутин. Изомерите на въглеродния скелет са в пентина и следващите хомолози. Пространственият изомер на ацетиленовите въглеводороди не се проявява по отношение на тройната връзка.
Първите 4 етанолови хомолози са газове, които са слабо разтворими във вода. Ацетиленови въглеводороди5 - C15 - течност. Твърдите вещества са хомолози на етан, като се започва от въглеводород С17. Химичното естество на алкините е значително повлияно от тройната връзка. Въглеводороди от това тип по-активен от етилен, прикрепете различни частици. Това свойство се основава на широкото използване на етан в промишлеността и инженерството. При изгарянето на ацетилен се отделя голямо количество топлина, което намира приложение при газово рязане и заваряване на метали.
 Първият представител на алкени е етилен. Физични свойства, производство, приложение на етилен
Първият представител на алкени е етилен. Физични свойства, производство, приложение на етилен Бензен Формула: кое от вариантите е правилно?
Бензен Формула: кое от вариантите е правилно? Формулата на толуен: какво е толуен и как да го получи?
Формулата на толуен: какво е толуен и как да го получи? Химическата формула на глицерина. Структурна и молекулна формула
Химическата формула на глицерина. Структурна и молекулна формула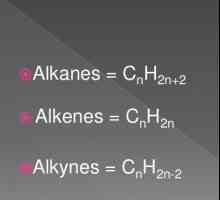 Общата формула на алкените. Свойства и характеристики на алкени
Общата формула на алкените. Свойства и характеристики на алкени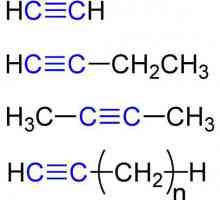 Химични свойства на алкините. Структура, приемане, приложение
Химични свойства на алкините. Структура, приемане, приложение Как да направите изомери и хомолози? Как да направите изомери на алкани?
Как да направите изомери и хомолози? Как да направите изомери на алкани?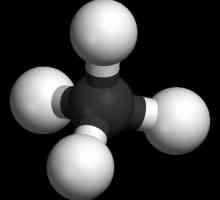 Алкадиените са типични представители на ненаситени въглеводороди
Алкадиените са типични представители на ненаситени въглеводороди Как да получите ацетилен от метан
Как да получите ацетилен от метан Какво представлява систематичната номенклатура
Какво представлява систематичната номенклатура Алифатни въглеводороди са какво?
Алифатни въглеводороди са какво? Структурните изомери са това, което
Структурните изомери са това, което Какво представлява бензенът? Структурата на бензена, формулата, свойствата, приложението
Какво представлява бензенът? Структурата на бензена, формулата, свойствата, приложението Пентан: изомери и номенклатура
Пентан: изомери и номенклатура Органични съединения и тяхната класификация
Органични съединения и тяхната класификация Гранични въглеводороди: общи характеристики, изомеризъм, химични свойства
Гранични въглеводороди: общи характеристики, изомеризъм, химични свойства Серията хомология
Серията хомология Ненаситени въглеводороди: алкени, химични свойства и приложение
Ненаситени въглеводороди: алкени, химични свойства и приложение Химични свойства на ацетилен, основни химични реакции, приложение
Химични свойства на ацетилен, основни химични реакции, приложение Алкини: производство, приложение, свойства
Алкини: производство, приложение, свойства Каква е рационалната номенклатура
Каква е рационалната номенклатура