Оксиди, соли, основи, киселини. Свойства на оксиди, основи, киселини, соли
Съвременната химическа наука е набор от разнообразни отрасли, като всяка от тях, освен теоретичната база, има голямо практическо значение. Каквото и да докосвате, всичко наоколо е продуктите на химическото производство. Основните секции са неорганична и органична химия. Нека разгледаме какви основни класове вещества се приписват на неорганичните и какви свойства притежават.
съдържание
- Основни категории неорганични съединения
- Група съединения - оксиди
- Характеризиране на оксиди
- С какво взаимодействат оксидите?
- Органични и неорганични киселини
- Свойства на неорганичните киселини
- Хидроксиди: алкали, амфотерни и неразтворими основи
- Основните характеристики на базите
- Клас от неорганични соли. Класификация, физични свойства
- Химични взаимодействия за клас средни соли
Основни категории неорганични съединения
За тези, които обикновено се включват следните:
- Окиси.
- Сол.
- Base.
- Киселина.
Всеки от класовете е представен от голямо разнообразие от съединения от неорганичен характер и е от значение в почти всяка структура на икономическата и промишлена дейност на човека. Всички основни характеристики, характерни за тези съединения, които са в природата и получават, се изучават в училищния курс по химия, без да се провалят, в класове 8-11.
Налице е обща таблица на оксиди, соли, основи, киселини, в които са представени примери за всяко от веществата и тяхното агрегатно състояние, които са в природата. Също така са показани взаимодействията, описващи химичните свойства. Все пак, ще разгледаме всеки от класовете поотделно и по-подробно.

Група съединения - оксиди
Оксидите са клас неорганични съединения, състоящ се от два елемента (двоичен), единият от които е винаги О (кислород) с ниска степен на окисление -2, стоящ на второ място в емпиричната формула на веществото. Пример: N2ох5 CaO и така нататък.
Оксидите се класифицират както следва.
I. Неподходящи за образуване на соли.
II. Сол-образуващи - са в състояние да образуват соли (с бази, амфотерни съединения, една с друга, киселини).
- Киселинните киселини - когато навлизат във водата, образуват киселини. Те се образуват най-често от неметали или от метали с висок СО (степен на окисление).
- Основните - при влизане във водните форми. Създадени от метални елементи.
- Amphoteric - показват киселинно-основна двойна природа, която се определя от реакционните условия. Съставен от преходни метали.
- Смесени - често се отнасят до соли и се образуват от елементи в няколко степени на окисляване.
По-високият оксид е оксид, в който формиращият елемент е в състояние на максимално окисление. Пример: Te+6. За телур максималното състояние на окисление е +6, което означава TeO3 - най-високият оксид за този елемент. В периодичната система под всяка група елементи е подписана обща емпирична формула, която отразява най-високия оксид за всички елементи в тази група, но само основната подгрупа. Например, под първата група елементи (алкални метали) има формула с формата R2О, което означава, че всички елементи на основната подгрупа в тази група ще имат точно тази формула на по-висок оксид. Пример: Rb2За, Cs2O и така нататък.
Когато висшият оксид се разтваря във вода, получаваме съответния хидроксид (алкален, киселинен или амфотерен хидроксид).

Характеризиране на оксиди
Оксидите могат да съществуват във всички агрегатни състояния при нормални условия. Повечето от тях са в твърда кристална или прахообразна форма (CaO, SiO2), някои KO (киселинни оксиди) се срещат под формата на течности (Mn2О7), както и газове (NO, NO2). Това се обяснява със структурата на кристалната решетка. Оттук и разликата в температурите на кипене и топене, които варират от представители от -2720C до + 70-800C (понякога по-висока). Разтворимостта във водата е различна.
- Разтворими - основни метални оксиди, наречени алкални, алкалоземни и всички кисели, освен силициев оксид (IV).
- Неразтворими - амфотерни оксиди, всички други основни и SiO2.
С какво взаимодействат оксидите?
Оксидите, солите, основите и киселините показват сходни свойства. Общите свойства на практически всички оксиди (с изключение на несъдържащи сол) са способността да се образуват различни соли в резултат на определени взаимодействия. Все пак за всяка група окиси са характерни техните специфични химични характеристики, отразяващи свойствата.
| Основни оксиди - ОО | Киселинни оксиди - CO | Двойни (амфотерни) оксиди - AO | Оксиди, които не образуват соли |
1. Реакции с вода: образуването на алкали (окиси на алкални и алкалоземни метали) Fr2О + вода = 2FrOH 2. Реакции с киселини: образуване на соли и вода киселина+ мен+пО = Н2О + сол 3. Реакции с KO, образуване на соли и вода литиев оксид + азотен оксид (V) = 2LiNO3 4. Реакции, в резултат на които елементите променят CO мен+пО + С = Ме0 + CO | 1. Реактивна вода: образуване на киселини (SiO2 изключение) KO + вода = киселина 2. Реакции с основи: CO2 + 2CsOH = Cs2CO3 + Н2О 3. Реакции с основни оксиди: образуване на соли P2О5 + 3MnO = Mn3(PO3)2 4. OVR реакции: CO2 + 2Ca = C + 2CaO, | Те проявяват двойни свойства, взаимодействат съгласно принципа на киселинно-базовия метод (с киселини, основи, основни оксиди, киселинни оксиди). Водата не взаимодейства с водата. 1. С киселини: образуване на соли и вода AO + киселина = сол + Н2ох 2. С бази (алкали): образуване на хидрокси-комплекси Al2О3 + LiOH + вода = Li [А1 (ОН)4] 3. Реакции с киселинни оксиди: получаването на соли FeO + SO2 = FeSO3 4. Реакции с ОО: образуване на соли, синтез MnO + Rb2О = двойна сол Rb2манганов2 5. Реакции на сливане с карбонати на алкални и алкални метали: образуване на соли Al2О3 + 2LiOH = 2LiAlO2 + Н2О | Не образувайте киселини или основи. Те показват много специфични свойства. |
Всеки висш оксид, образуван от метал и неметал, който се разтваря във вода, дава силна киселина или алкали.
Органични и неорганични киселини
При класически звук (въз основа на позициите на ED - електролитна дисоциация - Svante Arrhenius), киселините са съединения, които се разпадат на катиони H+ и аниони на киселинни остатъци-. Днес обаче киселините са били напълно изучени в безводни условия, така че има много различни теории за хидроксидите.
Емпиричните формули на оксиди, основи, киселини, соли се състоят само от символи, елементи и индекси, показващи тяхното количество в материята. Например, неорганичните киселини се изразяват чрез формулата Н+ киселинен остатък n-. Органичното вещество има друго теоретично представяне. Освен емпирично, могат да бъдат написани на пълни и кондензирано структурна формула, която ще се отрази не само на състава и количеството на молекулите, но реда на подреждане на атоми, връзката им един с друг и основна функционална група, за карбоксилни киселини -СООН.
Неорганичните киселини са разделени на две групи:
- аноксичен - HBr, HCN, HCL и други;
- Кислородсъдържащи (оксо киселини) - HClO3 и всичко, където има кислород.
Също така неорганичните киселини се класифицират по стабилност (стабилна или стабилна - всичко, с изключение на въглища и сулфиди, нестабилни или нестабилни - въглища и сяра). Силата на киселината може да бъде силна: сярна, хлороводородна, азотна, хлорна и други, а също и слаба: сероводород, хипохлор и други.

Органичната химия не е толкова разнообразна. Киселините, които са от органичен характер, се отнасят до карбоксилни киселини. Общата им черта е присъствието на функционалната група -COOH. Например, HNSO (мравка), CH3СООН (оцетна), С17Н35СООН (стеаринова киселина) и други.
Съществуват редица киселини, които особено внимателно се подчертават при разглеждането на тази тема в училищния курс по химия.
- Сол.
- Азотният.
- Фосфорна.
- Хидробромна киселина.
- Въглища.
- Водороден йодид.
- Сярна.
- Оцет или етан.
- Бутан или масло.
- Бензоена.
Тези 10 киселини в химията са основните вещества от съответния клас както в училищния курс, така и в промишлеността и синтезата като цяло.

Свойства на неорганичните киселини
Основните физически свойства трябва да се отдадат преди всичко на различно агрегатно състояние. В края на краищата, има ред киселини, които при обикновени условия приличат на кристали или прахове (борни, ортофосфорни). По-голямата част от известните неорганични киселини са различни течности. Точките на кипене и топене също се различават.
Киселините могат да предизвикат тежки изгаряния, тъй като те имат сила, която разрушава органичните тъкани и кожата. За откриване на индикатори за употреба на киселини:
- метлоланг (в обичайния среден - оранжев, в киселините - червен),
- лакмус (в неутрално - лилаво, в киселини - червено) или някои други.
Най-важните химични свойства включват способността за взаимодействие както с прости, така и с комплексни вещества.
| С това, което взаимодействат | Примерна реакция |
1. С обикновени метални вещества. Предпоставка: металът трябва да стои в EHRNM на водород, тъй като металите, които стоят след водород, не могат да го изместят от киселинния състав. В резултат на реакцията водородът винаги се образува под формата на газ и сол. | HCL + AL = алуминиев хлорид + Н2 |
2. С бази. Резултатът от реакцията е сол и вода. Такива реакции на силни киселини с алкали се наричат реакции на неутрализация. | Всяка киселина (силна) + разтворима база = сол и вода |
| 3. С амфотерни хидроксиди. Резултат: сол и вода. | 2HNO2 + берилиев хидроксид = Be (NO2)2 (средна сол) + 2Н2О |
| 4. С основни оксиди. Резултат: вода, сол. | 2HCL + FeO = железен хлорид (II) + Н2О |
| 5. С амфотерни оксиди. Крайният ефект: сол и вода. | 2HI + ZnO = ZnI2 + Н2О |
6. С соли, образувани от по-слаби киселини. Крайният ефект: сол и слаба киселина. | 2HBr + MgCO3 = магнезиев бромид + Н2O + CO2 |
Не всички киселини реагират еднакво на металите. Химията (клас 9) в училище предполага много плитко изследване на такива реакции, но на това ниво се вземат предвид и специфичните свойства на концентрирана азотна и сярна киселина при взаимодействие с метали.
Хидроксиди: алкали, амфотерни и неразтворими основи
Оксиди, соли, основи, киселини - всички тези класове вещества имат обща химическа природа, поради структурата на кристалната решетка, както и взаимното влияние на атомите в състава на молекулите. Въпреки това, ако е възможно да се даде много специфично определение за оксиди, тогава е по-трудно да се направят киселини и основи.
Както киселини, основите по теорията на ЕД са вещества, способни да се разграждат в метални катиони във воден разтворn + и хидроксилни групи аниони OH-.
Разделете категориите на базата, както следва:
- Разтворими или алкални (силни основи, които променят цвета на индикаторите). Съставени от метали от групи I, II. Пример: KOH, NaOH, LiOH (т.е. се вземат предвид само основните подгрупи);
- Ниска разтворима или неразтворима (средна якост, която не променя цвета на индикаторите). Пример: магнезиев хидроксид, желязо (II), (III) и други.
- Молекулните (слаби основи, във водна среда, обратимо се дисоциират в йонни молекули). Пример: N2Н4 амини, амоняк.
- Амфотерни хидроксиди (проявяват двойни свойства на основната киселина). например: алуминиев хидроксид, берилий, цинк и др.

Всяка представена група е изучавана в курса по химия в секцията "Фондации". Химия 8-9 клас предполага подробно изследване на алкали и слабо разтворими съединения.
Основните характеристики на базите
Всички алкали и слабо разтворими съединения са в природата в твърдо кристално състояние. В същото време техните точки на топене обикновено са ниски и слабо разтворимите хидроксиди се разлагат при нагряване. Цветът на базите е различен. Ако алкалът е бял, тогава кристалите на умерено разтворими и молекулни основи могат да бъдат с много различен цвят. Разтворимостта на повечето съединения от този клас може да се намери в таблицата, в която са представени оксиди, основи, киселини, соли, тяхната разтворимост е показана.
Алкалите могат да променят цвета на индикаторите, както следва: фенолфталеин - червено, метлоланж - жълто. Това се осигурява от свободното присъствие на хидроксилни групи в разтвора. Ето защо лошо разтворимите основи на такава реакция не дават.
Химичните свойства на всяка група бази са различни.
| Химични свойства | ||
| основи | Ниско разтворими основи | Амфотерни хидроксиди |
I. Взаимодействайте с KO (общо сол и вода): 2LiOH + SO3 = Li2SO4 + вода II. Взаимодействайте с киселини (сол и вода): конвенционалните реакции на неутрализация (вижте киселините) III. Взаимодействайте с АО, за да образувате хидроксилен комплекс от сол и вода: 2NaOH + Me+п О = Na2мен+п О2 + Н2О или Na2[Me+п (ОН)4] IV. Взаимодействайте с амфотерни хидроксиди с образуване на хидроложки соли: Същото като с AO, само без вода V. Взаимодействат с разтворими соли, за да образуват неразтворими хидроксиди и соли: 3С5ОН + железен хлорид (III) = Fe (OH)3 + 3CsCl VI. Взаимодействайте с цинк и алуминий във воден разтвор с образуване на соли и водород: 2RbOH + 2Al + вода = комплекс с хидроксиден йон 2Rb [А1 (ОН)4] + ЗН2 | I. При нагряване те могат да се разпаднат: неразтворим хидроксид = оксид + вода II. Реакции с киселини (общо: сол и вода): Fe (OH)2 + 2HBr = FeBr2 + вода III. Взаимодействайте с KO: мен+п (ОН)п + KO = сол + Н2О | I. Реагирайте с киселини за образуване на сол и вода: Меден хидроксид (II) + 2НВг = CuBr2 + вода II. Реагирайте с алкали: общо - сол и вода (условие: синтез) Zn (OH)2 + 2С5ОН = сол + 2Н2О III. Реагирайте със силни хидроксиди: резултатът е соли, ако реакцията е във воден разтвор: Cr (OH)3 + 3RbOH = Rb3[Cr (OH)6] |
Това са повечето от химичните свойства, които показват основата. Химията на основите е достатъчно проста и се подчинява на общите закони на всички неорганични съединения.
Клас от неорганични соли. Класификация, физични свойства
Въз основа на разпоредбите на ЕД, солите могат да се наричат неорганични съединения във воден разтвор, дисоцииращ се в метални катиони, Ме+п и аниони на киселинни остатъциn-. Така че можете да си представите солта. Определението за химия не дава едно, но това е най-точното.
В същото време в химическия си характер, всички соли са разделени на:
- Киселинен (имащ катион в състава). Пример: NaHSO4.
- Основен (имащ в състава на хидроксилната група). Пример: MgOHNO3, FeOHCL2.
- Средна (състои се само от метален катион и киселинен остатък). Пример: NaCL, CaSO4.
- Двойна (включвайте два различни метални катиони). Пример: NaAl (SO4)3.
- Комплекс (хидрокоплекси, аквакомплекси и други). Пример: До2[Fe (CN)4].
Солените формули отразяват тяхната химическа природа и също така говорят за качествения и количествен състав на молекулата.

Оксидите, солите, основите, киселините имат различни разтворими свойства, които могат да се видят в съответната таблица.
Ако говорите за общото състояние на солите, трябва да забележите тяхната монотонност. Те съществуват само в твърдо, кристално или прахообразно състояние. Цветовата схема е доста разнообразна. Разтворите на комплексни соли обикновено имат ярки, наситени цветове.
Химични взаимодействия за клас средни соли
Те имат сходни химични свойства на база, киселина, сол. Оксидите, както вече видяхме, се различават в известна степен от този фактор.
Общо, съществуват 4 основни типа взаимодействия за средни соли.
I. Взаимодействие с киселини (само силни от гледна точка на ЕД) с образуването на друга сол и слаба киселина:
KCNS + HCL = KCL + HCNS
II. Реакции с разтворими хидроксиди с появата на соли и неразтворими основи:
на меден4 + 2LiOH = 2LiSO4 сол разтворим + Cu (OH)2 неразтворима база
III. Взаимодействие с друга разтворима сол, за да се образува неразтворима сол и разтворима:
PbCL2 + Na2S = PbS + 2NaCL
IV. Реакции с метали, които стоят в ЕКПЧ отляво на това, което образува солта. В този случай металът, който реагира при нормални условия, не трябва да взаимодейства с вода:
Mg + 2AgCL = MgCL2 + 2ag
Това са основните типове взаимодействия, които са характерни за средните соли. Формулите на солите на комплексни, основни, двойни и киселини сами по себе си говорят за спецификата на изложените химични свойства.

Формулите на оксиди, основи, киселини, соли отразяват химическата същност на всички представители на тези класове неорганични съединения и дават представа за наименованието на веществото и неговите физични свойства. Следователно, тяхното писане трябва да обърне специално внимание. Огромно разнообразие от съединения ни предлага като цяло удивителна наука - химия. Оксиди, основи, киселини, соли - това е само част от огромното разнообразие.
 Качествени реакции към органични вещества, аниони, катиони
Качествени реакции към органични вещества, аниони, катиони Химични, физични свойства на веществата
Химични, физични свойства на веществата Химия: оксиди, тяхната класификация и свойства
Химия: оксиди, тяхната класификация и свойства Неорганични вещества
Неорганични вещества Каква е същността на оксидите
Каква е същността на оксидите Неорганичната химия е какво? Неорганична химия в училищната учебна програма
Неорганичната химия е какво? Неорганична химия в училищната учебна програма Какво има значение: класове, характеристики, свойства. Физични свойства на веществото
Какво има значение: класове, характеристики, свойства. Физични свойства на веществото Неорганична химия. Обща и неорганична химия
Неорганична химия. Обща и неорганична химия Основни хидроксиди и техните химични свойства
Основни хидроксиди и техните химични свойства Алкални метали
Алкални метали Класове неорганични съединения
Класове неорганични съединения Киселинни оксиди: кратко описание на групата
Киселинни оксиди: кратко описание на групата Основни оксиди и техните свойства
Основни оксиди и техните свойства Оксиди. Натриеви и несъдържащи сол оксиди
Оксиди. Натриеви и несъдържащи сол оксиди Основни соли. Категория "борати"
Основни соли. Категория "борати" Химични свойства на солите и методи за тяхното получаване
Химични свойства на солите и методи за тяхното получаване Основни сектори на химията: описание, характеристики и интересни факти
Основни сектори на химията: описание, характеристики и интересни факти Неорганични вещества: примери и свойства
Неорганични вещества: примери и свойства Окиси. Примери, класификация, свойства
Окиси. Примери, класификация, свойства Киселинните оксиди включват неметални оксиди: примери, свойства
Киселинните оксиди включват неметални оксиди: примери, свойства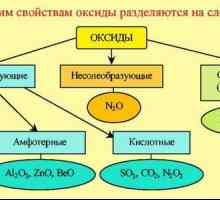 Кислородсъдържащи съединения: примери, свойства, формули
Кислородсъдържащи съединения: примери, свойства, формули