Твърди вещества: свойства, структура, плътност и примери
Твърдите вещества са тези, които са способни да образуват тела и да имат обем. От течности и газове те се различават по своята форма. Твърдите вещества запазват формата на тялото поради факта, че техните частици не могат да се движат свободно. Те се различават по тяхната плътност, пластичност, електрическа проводимост и цвят. Те имат и други свойства. Например, повечето от тези вещества се топят по време на нагряване, като се получи течно агрегатно състояние. Някои от тях, когато се нагорещят, веднага се превръщат в газ (възвишена). Но има и такива, които се разлагат на други вещества.
съдържание
Видове твърди вещества
Всички твърди вещества са разделени на две групи.
- Аморфна, в която отделните частици са разположени хаотично. С други думи: те нямат ясна (определена) структура. Тези твърди вещества могат да се стопят в известен температурен диапазон. Най-често срещаните от тях могат да бъдат приписани стъкло и смола.
- Кристален, който на свой ред е разделен на 4 вида: атомна, молекулярна, йонна, метална. В тях частиците се намират само по определена схема, а именно в възлите на кристалната решетка. Нейната геометрия в различни вещества може да варира значително.
Твърдите кристални вещества преобладават над аморфния брой.

Видове кристални твърди вещества
В твърдо състояние почти всички вещества имат кристална структура. Те се различават по своята структура. Кристалните решетки в техните възли съдържат различни частици и химически елементи. Съгласно тях те получиха имената си. Всеки тип има своите характерни свойства:
- В атомна кристална решетка частиците на твърдото вещество се свързват чрез ковалентна връзка. Тя се отличава със своята сила. Поради това такива вещества се отличават с висока точка на топене и кипене. Кварц и диамант са от този тип.
- В молекулярната кристална решетка връзката между частиците се отличава със своята слабост. Веществата от този тип се характеризират с лекота на кипене и топене. Те се различават по волатилността, поради което имат определена миризма. Такива твърди тела включват лед, захар. Подвижностите на молекулите в твърдите вещества от този тип се различават в тяхната активност.
- В йонна кристална решетка при възлите съответните частици се редуват, зареждат се положително и отрицателно. Те се държат чрез електростатично привличане. Този тип решетка съществува в алкали, соли, основни оксиди. Много вещества от този тип са лесно разтворими във вода. Поради доста силната връзка между йоните, те са огнеупорни. Почти всички те са без мирис, тъй като се характеризират с нестабилност. Веществата от йонна решетка не са в състояние да провеждат електрически ток, тъй като те не съдържат свободни електрони. Типичен пример за йонно твърдо вещество е натриевият хлорид. Такава кристална решетка го прави крехка. Това се дължи на факта, че всяка от неговите смени може да доведе до появата на йонни отблъскващи сили.
- В метална кристална решетка присъстват само йони от химически вещества в възлите, които са положително заредени. Между тях има свободни електрони, през които топлинната и електрическата енергия преминават перфектно. Ето защо всички метали се различават по подобен признак като проводимост.

Общи понятия за твърдо вещество
Твърдите тела и вещества са практически едно и също нещо. Тези термини са една от четирите съвкупни състояния. Твърдите тела имат стабилна форма и характер на топлинното движение на атомите. Последните правят малки колебания до позициите на равновесие. Секцията на науката, която се занимава с изучаването на състава и вътрешната структура, се нарича физика на твърдото тяло. Съществуват и други важни сфери на познание, които се занимават с такива вещества. Промяната на формата при външни влияния и движение се нарича механиката на деформираното тяло.
Поради различните свойства на твърдите вещества те са намерили приложение в различни технически средства, създадени от човека. Най-често техните свойства се основават на такива свойства като твърдост, обем, маса, еластичност, пластичност и крехкост. Съвременната наука позволява използването на други качества на твърди вещества, които могат да бъдат открити изключително в лабораторията.
Какви са кристалите?
Кристалите са твърди частици с частици, подредени в определен ред. На всеки химично вещество съответства на структурата му. Атомите му формират триизмерно-периодично полагане, наречено кристална решетка. Твърдите вещества имат различна структура на симетрия. Кристалното състояние на твърдо вещество се счита за стабилно, тъй като има минимално количество потенциална енергия.
По-голямата част от твърдите материали (естествени) се състои от огромно количество случайно ориентирани отделни зърна (кристалити). Такива вещества се наричат поликристални. Те включват технически сплави и метали, както и много скали. Единичните кристали се наричат единични естествени или синтетични кристали.
Най-често такива твърди вещества се образуват от състоянието на течната фаза, представена от стопилката или разтвора. Понякога те се получават от газовото състояние. Този процес се нарича кристализация. Благодарение на научния и техническия прогрес се развива процесът на отглеждане (синтезиране) на различни вещества. Повечето кристали имат естествена форма във формата обикновена полихедрия. Размерите им са много различни. Така естественият кварц (скален кристал) може да тежи до стотици килограми, а диамантите - до няколко грама.

В аморфните твърди вещества, атомите са в постоянно колебание около хаотично разположените точки. Те запазват определена поръчка с малък обсег, но няма поръчка за дълги разстояния. Това се дължи на факта, че техните молекули се намират на разстояние, което може да бъде сравнено с техния размер. Най-честият пример в живота ни за такова твърдо вещество е стъкленото състояние. Аморфни вещества често се счита за течност с невероятно висок вискозитет. Времето за тяхното кристализиране понякога е толкова голямо, че изобщо не се появява.
Това са горните свойства на тези вещества, които ги правят уникални. Аморфните твърди вещества се считат за нестабилни, тъй като те в крайна сметка могат да преминат в кристално състояние.
Молекулите и атомите, които съставляват твърдото вещество, са опаковани с висока плътност. Те практически запазват взаимната си позиция по отношение на други частици и се държат заедно чрез междумолекулно взаимодействие. Разстоянието между молекулите на твърдото вещество в различни посоки се нарича параметър на кристалната решетка. Структурата на веществото и неговата симетрия определят различни свойства, като електронната зона, разцепването и оптиката. Когато се излагат на твърдо вещество с достатъчно висока якост, тези качества могат до известна степен да бъдат нарушени. В този случай твърдото вещество е обект на трайна деформация.
Атомите на твърдите вещества извършват вибрационни движения, които се дължат на притежаването на топлинна енергия. Тъй като те са незначителни, те могат да бъдат наблюдавани само при лабораторни условия. Молекулярна структура твърдото вещество оказва голямо влияние върху неговите свойства.

Проучване на твърди вещества
Характеристиките, свойствата на тези вещества, тяхното качество и движението на частиците се изследват в различни подсекции на физиката на твърдото тяло.
За използваното изследване: радиоспектроскопия, структурен анализ, използващ рентгенови лъчи и други методи. Така че изследваме механичните, физичните и топлинните свойства на твърдите вещества. Твърдост, устойчивост на натоварвания, крайна сила, фазови трансформации, научни изследвания на материалите. Той до голяма степен резонира с физиката на твърдите вещества. Има и друга важна съвременна наука. Изследването на съществуващите и синтезирането на нови вещества се извършва чрез химия в твърдо състояние.
Характеристики на твърдите вещества
Естеството на движението на външните електрони на твърдите атоми определя много от неговите свойства, например електрически свойства. Има 5 класа на такива органи. Те се установяват в зависимост от вида на връзката на атомите:
- Йоните, чиято основна характеристика е силата на електростатичната атракция. Характеристиките му: отражение и абсорбиране на светлината в инфрачервения регион. При ниски температури йонната връзка се характеризира с ниска електрическа проводимост. Пример за такова вещество е натриевата сол на хлороводородната киселина (NaCl).
- Ковалент, извършен благодарение на електронната двойка, която принадлежи и на двата атома. Тази връзка е разделена на: единична (проста), двойна и тройна. Тези имена показват наличието на електронни двойки (1, 2, 3). Двойните и тройните връзки се наричат множество. Има още едно разделение на тази група. Така, в зависимост от разпределението на електронната плътност, се изолира полярна и неполярна връзка. Първият е формиран от различни атоми, а вторият е същият. Такова твърдо състояние на материята, примери за които са диамант (С) и силиций (Si), се отличава с неговата плътност. Най-тежките кристали принадлежат към ковалентната връзка.
- Метал, образуван чрез комбиниране на валентните електрони на атомите. В резултат на това има общ електронен облак, който се премества под въздействието на електрическото напрежение. Създава се метална връзка, когато свързаните атоми са големи. Те са тези, които могат да предават електрони. За много метали и сложни съединения се формира твърдо състояние на веществото от тази връзка. Примери: натрий, барий, алуминий, мед, злато. От неметалните съединения може да се отбележи следното: AlCr2, Ca2Cu, Cu5Zn8. Веществата с метална връзка (метали) са разнообразни във физическите свойства. Те могат да бъдат течни (Hg), меки (Na, K), много твърди (W, Nb).
- Молекулярни, възникващи в кристали, които се образуват от отделни молекули на материята. Характеризира се с пропуски между молекулите с нулева електронна плътност. Силите свързващи атоми в тези кристали са значителни. В този случай молекулите се привличат един към друг само чрез слабо междумолекулно привличане. Ето защо връзките между тях лесно се разрушават при загряване. Връзките между атомите са много по-сложни. Молекулната връзка е разделена на ориентация, дисперсия и индукция. Пример за такова вещество е твърдият метан.
- Водород, който възниква между положително поляризираните атоми на молекулата или част от нея и отрицателно поляризираната най-малка частица от друга молекула или друга част. Тези връзки включват лед.

Свойства на твърдите вещества
Какво знаем днес? Учените отдавна са изследвали свойствата на твърдото състояние на материята. Когато температурата е засегната, също се променя. Преходът на такова тяло в течност се нарича синтез. Трансформацията на твърдо вещество в газово състояние се нарича сублимация. Тъй като температурата се понижава, се извършва втвърдяване. Някои вещества под влиянието на студ преминават в аморфната фаза. Този процес се нарича витрификация от учените.
В случай на фазови преходи, вътрешната структура на твърдите вещества се променя. Най-високата подреденост, която придобива, когато температурата се понижи. При атмосферно налягане и температура T> 0 K се втвърдяват всички съществуващи в природата вещества. Само хелий, чиято кристализация е необходим под налягане от 24 atm, представлява изключение от това правило.
Твърдото вещество на веществото му дава различни физични свойства. Те характеризират специфичното поведение на телата под влиянието на определени полета и сили. Тези свойства са разделени на групи. Има 3 режима на експозиция, съответстващи на 3 вида енергия (механична, термична, електромагнитна). Съответно има 3 групи физични свойства на твърдите вещества:
- Механични свойства, свързани със стрес и деформация на телата. Съгласно тези критерии твърдите вещества са разделени на еластични, реологични, силни и технологични. В покой, такова тяло запазва своята форма, но може да се промени под въздействието на външна сила. В този случай нейната деформация може да бъде пластична (първоначалната форма не се връща), еластична (връща се в оригиналната си форма) или разрушителна (когато се достигне определен праг, настъпва разпад / прекъсване). Отговорът на приложената сила е описан от еластичните модули. Здравото тяло се противопоставя не само на компресията, разтягането, но и на смени, усукване и огъване. Силата на твърдото тяло се нарича свойство да се противопоставя на унищожението.
- Термично, изразено при излагане на топлинни полета. Една от най-важните свойства е точката на топене, при която тялото преминава в течно състояние. Отбелязва се кристално твърдо вещество. Аморфните тела имат латентна топлина на сливане, тъй като преминаването им в течно състояние с повишаваща се температура настъпва постепенно. При достигане на определена топлина аморфното тяло губи своята еластичност и придобива пластичност. Това състояние означава, че достига температурата на преход на стъкло. При нагряване се извършва деформация на твърдото вещество. И често се разширява. Количествено, това състояние се характеризира с определен коефициент. Температурата на тялото оказва влияние върху механичните характеристики като течливост, пластичност, твърдост и здравина.
- Електромагнитни, свързани с въздействието на микрочастици и електромагнитни вълни с голяма здравина върху потоците от твърда материя. За тях се вземат предвид и радиационните свойства.

Структура на зоната
Твърдите вещества се класифицират по така наречената структура на лентите. Така че, сред тях се отличават:
- Проводници, които се различават по това, че техните проводими и валентни ленти се припокриват. В този случай електроните могат да се движат между тях, като получават и най-малката енергия. Проводниците включват всички метали. Когато се приложи потенциална разлика за такова тяло, се образува електрически ток (поради свободното движение на електроните между точките с най-малък и най-голям потенциал).
- Диелектрици, чиито зони не се припокриват. Интервалът между тях надвишава 4 eV. За да носите електрони от валентността до проводящата зона, е необходимо голямо количество енергия. Поради тези свойства на диелектриците, практически не тече потоци.
- Полупроводници, характеризиращи се с липсата на проводими и валентни ленти. Интервалът между тях е по-малък от 4 eV. За да прехвърляме електроните от валентната лента в проводящата зона, се нуждаем от енергия, по-малка от тази за диелектриците. Чистите (нежелани и присъщи) полупроводници слабо преминават през тока.
Подвижностите на молекулите в твърдите вещества причиняват техните електромагнитни свойства.
Други свойства
Твърдите вещества също се подразделят според техните магнитни свойства. Има три групи:
- Диамагнети, чиито свойства зависят малко от температурата или от състоянието на агрегиране.
- Парамагнити, които са следствие от ориентацията на проводимите електрони и магнитните моменти на атомите. Според закона на Кюри тяхната чувствителност намалява пропорционално на температурата. Така при 300 К е 10-5.
- Тела с подредена магнитна структура, притежаващи атоми с дълъг обхват. При възлите на решетката им периодично се намират частици с магнитни моменти. Такива твърди вещества и вещества често се използват в различни сфери на човешката дейност.

Най-здравите вещества в природата
Какви са те? Плътността на твърдите вещества до голяма степен определя тяхната твърдост. През последните години учените откриха няколко материала, които твърдят, че са "най-трайното тяло". Най-трудното вещество е фулеритът (кристал с молекули фулерен), който е около 1,5 пъти по-твърд от диаманта. За съжаление, тя все още се предлага само в много малки количества.
Към днешна дата най-солидното вещество, което по-късно може да се използва в индустрията, е lonsdaleite (шестоъгълен диамант). Той е с 58% по-твърд от диаманта. Lonsdale е алотропна модификация на въглерода. Кристалната му решетка е много подобна на диамантената решетка. Клетката на Lonsdaleit съдържа 4 атома, а диамантът - 8. От широко използваните кристали днес най-трудно остава диаманта.
 Как се намират частиците в твърди вещества, течности и газове?
Как се намират частиците в твърди вещества, течности и газове? Физическите органи са какво? Физически органи: примери, свойства
Физическите органи са какво? Физически органи: примери, свойства Диелектрик - какво е това? Свойства на диелектриците
Диелектрик - какво е това? Свойства на диелектриците Аморфни вещества. Кристално и аморфно състояние на материята. Използването на аморфни вещества
Аморфни вещества. Кристално и аморфно състояние на материята. Използването на аморфни вещества Какво се нарича вещество? Обикновени и сложни вещества: концепция
Какво се нарича вещество? Обикновени и сложни вещества: концепция Свойства и структура на газообразни, течни и твърди тела
Свойства и структура на газообразни, течни и твърди тела Теория на зоните на твърдите вещества. Квантова механика за манекени
Теория на зоните на твърдите вещества. Квантова механика за манекени Как преминава веществото от течно състояние към твърдо състояние?
Как преминава веществото от течно състояние към твърдо състояние?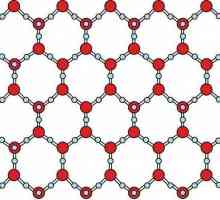 Молекулярната структура има ... Кое вещество има молекулярна структура
Молекулярната структура има ... Кое вещество има молекулярна структура Видове кристални решетки от различни вещества
Видове кристални решетки от различни вещества Агрегатно състояние на материята
Агрегатно състояние на материята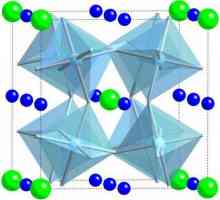 Електрическа проводимост на диелектриците. Видове диелектрици, техните свойства и приложения
Електрическа проводимост на диелектриците. Видове диелектрици, техните свойства и приложения Какви вещества се наричат чисти: определението на понятия и примери
Какви вещества се наричат чисти: определението на понятия и примери Обикновени вещества
Обикновени вещества Структурата на материята
Структурата на материята Молекулярна физика
Молекулярна физика Кристалната решетка и нейните основни типове
Кристалната решетка и нейните основни типове Йонична кристална решетка
Йонична кристална решетка Физични и химични свойства на металите
Физични и химични свойства на металите Неорганични вещества: примери и свойства
Неорганични вещества: примери и свойства Аморфни и кристални тела, техните свойства
Аморфни и кристални тела, техните свойства