Метална връзка: механизмът на образованието. Метални химични връзки: примери
Всички известни химически елементи, разположени в периодичната таблица, се разделят условно на две големи групи: метали и неметали. За да станат не само елементи, а съединения, химикали, те могат да взаимодействат помежду си, те трябва да съществуват под формата на прости и сложни вещества.
съдържание
- Видове химични връзки в съединенията
- Метали и техните физични свойства
- Метален тип химическа връзка
- Метална връзка: механизмът на образованието
- Видове метални кристали
- Характеристики на комуникацията: не-насоченост
- Saturability
- Примери за образуване на връзки в метали
- Сходство и разлика с други видове връзки
- Видове връзки в метали с различни агрегатни състояния
За тази цел някои електрони се опитват да приемат, а други - да дадат. Замествайки се по този начин, елементите формират различни химически молекули. Но какво им позволява да останат заедно? Защо има такива вещества, които не могат да бъдат унищожени дори и от най-сериозните инструменти? И други, напротив, са унищожени от най-малкото влияние. Всичко това се обяснява с формирането на различни видове химическа връзка между атомите в молекулите, образуването на кристална решетка с определена структура.

Видове химични връзки в съединенията
Общо има четири основни вида химически облигации.
- Ковалентна неполярна. Тя се формира между две еднакви неметали, поради социализацията на електрони, образуването на общи електронни двойки. В него се образуват непанални частици във валента. Примери: халогени, кислород, водород, азот, сяра, фосфор.
- Ковалентна полярна. Той се образува между два различни неметала или между метал, който е много слаб в свойствата и неметален слаб при електронегонактивност. В основата са също обикновените електронни двойки и тяхното привличане към себе си от този атом, чийто афинитет към електрона е по-висок. Примери: NH3 SiC, P2О5 и други.
- Водородна връзка. Най-нестабилната и слабата, се формира между силно електринговъчния атом на една молекула и положителната. Най-често това се случва, когато веществата се разтварят във вода (алкохол, амоняк и т.н.). Благодарение на такава връзка могат да съществуват макромолекули на протеини, нуклеинови киселини, сложни въглехидрати и т.н.
- Йонно свързване. Тя се формира поради силите на електростатично привличане на различни заредени метални йони и неметали. Колкото по-силна е разликата в този показател, толкова по-изразен е йонният характер на взаимодействието. Примери за съединения: бинарни соли, комплексни съединения - основи, соли.
- Металната връзка, механизмът на формиране на който, както и свойствата, ще бъдат разгледани допълнително. Тя се образува в метали, техните сплави от различни видове.
Има едно такова нещо като единството на химическата връзка. То просто казва, че е невъзможно да се разглежда всяка химическа връзка като отправна точка. Всички те са условно обозначени единици. В края на краищата, основата на всички взаимодействия е един принцип - електронно-статично взаимодействие. Следователно, йонната, металната, ковалентната връзка и водородната връзка имат една единствена химическа природа и са само гранични случаи една на друга.

Метали и техните физични свойства
Металите са в по-голямата част от всички химически елементи. Това се дължи на техните специални свойства. Значителна част от тях е получена от човека чрез ядрени реакции в лабораторията, те са радиоактивни с кратък полуживот.
Повечето от тях са естествени елементи, които образуват цели скали и руди, са част от най-важните съединения. От тях хората се научили да хвърлят сплави и да правят много красиви и важни продукти. Те са като мед, желязо, алуминий, сребро, злато, хром, манган, никел, цинк, олово и много други.
За всички метали могат да се разграничат общи физични свойства, което обяснява схемата за образуване на метална връзка. Какви са тези свойства?
- Ковкост и пластичност. Известно е, че много метали могат да се търкалят дори до състоянието на фолиото (злато, алуминий). От останалите се получават тел, метални гъвкави листове, продукти, способни да се деформират под физическо въздействие, но веднага да се възстанови формата след спирането й. Тези качества на металите се наричат ковък и пластичност. Причината за тази функция е металният тип връзка. Ионите и електроните в кристалния плъзгач се разтеглят един към друг без да се чупят, което позволява запазване на целостта на цялата структура.
- Метален блясък. Това обяснява и металната връзка, механизма на образованието, неговите характеристики и особености. По този начин, не всички частици са способни да абсорбират или отразяват светлинни вълни с еднаква дължина. Атомите на повечето метали отразяват късовълните лъчи и придобиват почти същия цвят сребърен, бял, бледо синкав оттенък. Изключенията са мед и злато, чийто цвят е съответно червеникаво-червен и жълт. Те са способни да отразяват по-дългата дължина на вълната.
- Топлинна и електрическа проводимост. Тези свойства се обясняват и от структурата на кристалната решетка и от факта, че при нейното формиране се осъществява метален тип връзка. Поради "електронния газ", движещ се вътре в кристала, електрическият ток и топлината се разпределят мигновено и равномерно между всички атоми и йони и се провеждат през метала.
- Твърдо състояние при нормални условия. Тук единственото изключение е живакът. Всички други метали са задължително силни, твърди съединения, както и техните сплави. Това също е резултат от наличието на метални връзки в металите. Механизмът на формиране на този тип свързване на частиците напълно потвърждава свойствата.
Това са основните физически характеристики на металите, което обяснява и определя точно схемата за образуване на метална връзка. Такъв метод на свързване на атоми за метални елементи и техните сплави е действителен. Това е за тях в твърдо и течно състояние.

Метален тип химическа връзка
Каква е нейната особеност? Въпросът е, че такава връзка се формира не за сметка на различно заредените йони и тяхното електростатично привличане, а не за сметка на разликата в електронегативността и присъствието на свободни електронни двойки. Това означава, че йонната, метална, ковалентна връзка има някаква различна природа и отличителни черти на свързаните частици.
Всички метали се характеризират с такива характеристики като:
- малък брой електрони външно енергийно ниво (с изключение на някои изключения, в които те могат да бъдат 6.7 и 8);
- голям атомен радиус;
- ниска йонизираща енергия.
Всичко това допринася за лесното отделяне на външните недвни ерони от ядрото. В атома има много свободни орбитали. Схемата за образуване на метална връзка просто ще показва припокриване на множество орбитални клетки от различни атоми една с друга, което в резултат образуват общо вътрешнокристално пространство. От него се подават електрони от всеки атом, които започват да се разхождат свободно около различни части на решетката. Периодично всеки от тях се свързва с йона в мястото на кристала и го превръща в атом, след това отново се отделя, образувайки йон.
Така металната връзка е връзка между атоми, йони и свободни електрони в общия метален кристал. Електронен облак, който се движи свободно в структурата, се нарича "електронен газ". Те обясняват мнозинството физични свойства метали и техните сплави.
Как точно работи свързването на метални химикали? Примери могат да бъдат дадени различни. Нека се опитаме да погледнем парче литий. Дори ако го вземете като грах, ще има хиляди атоми. Нека си представим, че всеки от тези хиляди атоми дава своя валентност един електронен в едно общо кристално пространство. В същото време, знаейки електронната структура на този елемент, можете да видите броя празни орбита. В литий, ще има 3 (p-орбиталите на второто енергийно ниво). Три от всеки атом от десетки хиляди - това е общото пространство вътре в кристала, в което "електронният газ" се движи свободно.

Вещество с метална връзка винаги е силно. В края на краищата, електронният газ не позволява на кристала да се разпада, но само измества слоевете и ги възстановява. Той свети, има определена плътност (най-често висока), трошливост, пластичност и пластичност.
Къде другаде е свързана с метал? Примери за вещества:
- метали под формата на прости структури;
- всички метални сплави един с друг;
- всички метали и техните сплави в течно и твърдо състояние.
Специфични примери могат да бъдат дадени просто невероятно количество, защото металите в периодичната система са повече от 80!
Метална връзка: механизмът на образованието
Ако го разглеждаме в общата му форма, вече сме очертали основните моменти по-горе. Наличие на свободен атомни орбитали и електрони, които лесно се отделят от ядрото поради ниската йонизираща енергия, са основните условия за формирането на този тип връзка. По този начин се оказва, че се реализира между следните частици:
- атоми в решетките;
- свободни електрони, които са валентни метали;
- йони в местата на кристалната решетка.
В резултат - метална връзка. Механизмът на образованието в обща форма се изразява в следния запис: Me0 - д- Harr Men +. От диаграмата е очевидно кои частици присъстват в кристала на метала.
Самите кристали могат да имат различни форми. Това зависи от конкретното вещество, с което се занимаваме.
Видове метални кристали
Тази структура на метала или неговата сплав се характеризира с много гъста опаковка на частици. Тя се осигурява от йони на кристалните обекти. Самата решетка може да бъде с различни геометрични форми в пространството.
- Централната центрирана кубична решетка е алкалните метали.
- Шестоъгълната компактна структура е алкална земя, с изключение на барий.
- Лице-центричен кубичен - алуминий, мед, цинк, много преходни метали.
- Ромбохедричната структура е в живак.
- Тетрагоналът е индий.
Най- тежък метал и колкото по-ниска е разположена в периодичната система, толкова по-сложна е неговата опаковка и пространствената организация на кристала. В този случай металната химическа връзка, примери за която може да се даде за всеки съществуващ метал, е от решаващо значение за конструкцията на кристала. Сплавите имат много разнообразни организации в космоса, някои от които все още не са напълно проучени.

Характеристики на комуникацията: не-насоченост
Ковалентните и металните връзки имат една много отличителна черта. За разлика от първата, металната връзка не е насочена. Какво означава това? Тоест, електронният облак вътре в кристала се движи напълно свободно в неговите граници в различни посоки, всеки от електроните е в състояние да се прикрепи към абсолютно всеки йон в възлите на структурата. Това означава, че взаимодействието се осъществява в различни посоки. Затова те казват, че металната връзка не е насочена.
Механизмът на ковалентната връзка предполага образуването на общи електронни двойки, т.е. облаци от припокриващи се атоми. И това се случва стриктно според определена линия, свързваща техните центрове. Затова говорим за посоката на такава връзка.
saturability
Тази характеристика отразява способността на атомите да имат ограничено или неограничено взаимодействие с другите. По този начин ковалентните и металните връзки в този индикатор отново са противоположни.
Първата е наситена. Атомите, участващи в неговото формиране, имат стриктно определен брой валентни външни електрони, които вземат пряко участие в образуването на съединението. Повече, отколкото е той, няма да има електрони. Следователно броят на образуваните облигации е ограничен от валентността. Оттук и насищането на връзката. Поради тази характеристика повечето съединения имат постоянен химичен състав.
Металните и водородните връзки, напротив, са ненаситени. Това се обяснява с наличието на множество свободни електрони и орбитали вътре в кристала. Също така ролята се играе от йони в решетките, всеки от които може да стане атом и отново йон по всяко време.

Друга характеристика на металната връзка е делокализирането на вътрешния електронен облак. Той се проявява в способността на малък брой общи електрони да обединяват много атомни метални ядра. Тоест, плътността, такава, каквато е била, е делокализирана, разпределена равномерно между всички връзки на кристала.
Примери за образуване на връзки в метали
Нека разгледаме няколко конкретни варианта, които илюстрират как се формира метална връзка. Примерите за вещества са, както следва:
- цинк;
- алуминий;
- калий;
- хром.
Образуване на метална връзка между цинкови атоми: Zn0 - 2е- harr- Zn2+. Атомът на цинка има четири енергийни нива. Свободен орбитал, въз основа на електронната структура, той има 15 - 3 на р-орбитата, 5 на 4 d и 7 на 4f. Електронната структура е, както следва: 1s22s22P63s23p64s23d104P04d04е0 , общо в атома от 30 електрона. Това означава, че две свободни валентни негативни частици могат да се движат в рамките на 15 просторни и незаети орбита. И така при всеки атом. В резултат на това има огромно общо пространство, състоящо се от празни орбитали и малък брой електрони, свързващи цялата структура заедно.
Метална връзка между алуминиеви атоми: AL0 - д- harr- AL3+ . Тринадесет електрона от алуминиев атом се намират на три енергийни нива, които очевидно са достатъчни за запълване. Електронна структура: 1s22s22P63s23p13d0. Безплатни орбита - 7 броя. Очевидно е, че облакът от електрони ще бъде малък в сравнение с общото вътрешно свободно пространство в кристала.

Метална връзка от хром. Този елемент е специален в своята електронна структура. В края на краищата, за да стабилизира системата, има неуспех на електрона от 4s до 3d орбитал: 1s22s22P63s23p64s13d54P04d04е0. Общо 24 електрона, от които шест са произведени. Те са тези, които влизат в общото електронно пространство за образуване на химически връзки. Безплатни орбита 15, което все още е много повече от необходимото за пълнене. Следователно, хромът също е типичен пример за метал с подходяща връзка в молекулата.
Един от най-активните метали, който реагира дори с обикновена вода със запалване, е калият. Какво обяснява тези свойства? Отново, в много отношения - метален тип връзка. В този елемент има само 19 електрона, но те се намират на 4 енергийни нива. Тоест, на 30 орбитала от различни подове. Електронна структура: 1s22s22P63s23p64s13d04P04d04е0. Само две валентни електрони, с много ниска йонизираща енергия. Освободете се и излезте в общото електронно пространство. Орбитален за преместване на един атом от 22 броя, т.е. много голямо свободно пространство за "електронен газ".
Сходство и разлика с други видове връзки
По принцип този въпрос вече беше обсъден по-горе. Човек може само да обобщи и да направи заключение. Основните отличителни белези на всички други видове комуникационни характеристики на металните кристали са:
- няколко типа частици, участващи в процеса на свързване (атоми, йони или атомни йони, електрони);
- различна пространствена геометрична структура на кристалите.
С водород и йонна връзка, металът комбинира ненасищане и ненасочена. С ковалентна полярна - силна електростатична атракция между частиците. Отделно с йонните - типа частици в възлите на кристалната решетка (йони). С ковалентни неполярни атоми в възлите на кристала.
Видове връзки в метали с различни агрегатни състояния
Както отбелязахме по-горе, металната химична връзка, примери за които са дадени в изделието, се формира в две агрегатни състояния на металите и техните сплави: твърди и течни.
Възниква въпросът: какъв е видът на връзката в металните пари? Отговор: ковалентни полярни и неполярни. Както във всички съединения под формата на газ. Това означава, че когато металът се нагрява дълго време и се прехвърля от твърдо състояние в течна връзка, кристалната структура се запазва. Обаче, когато става въпрос за прехвърляне на течност в състояние на пара, кристалът се разрушава и металната връзка се превръща в ковалентна.
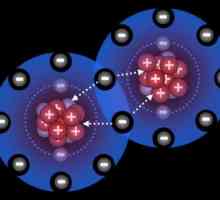 Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор?
Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор?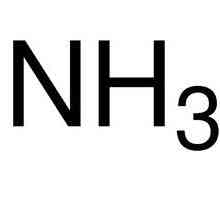 Определете валентността на химичните елементи
Определете валентността на химичните елементи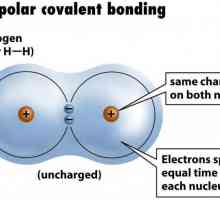 Пример за неполярна ковалентна връзка. Ковалентна връзка полярна и неполярна
Пример за неполярна ковалентна връзка. Ковалентна връзка полярна и неполярна Донор-акцепторна връзка: примери за вещества
Донор-акцепторна връзка: примери за вещества Неорганични вещества
Неорганични вещества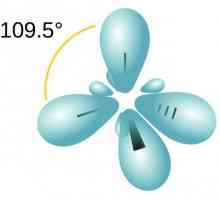 Нека да поговорим за това как да определим вида на хибридизацията
Нека да поговорим за това как да определим вида на хибридизацията Неметите са ...? Свойства на неметалните елементи
Неметите са ...? Свойства на неметалните елементи Видове кристални решетки от различни вещества
Видове кристални решетки от различни вещества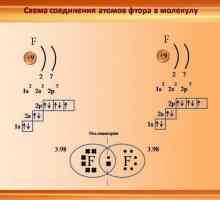 Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка
Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка Водородна връзка: примери и видове химически връзки
Водородна връзка: примери и видове химически връзки Основните видове химически връзки: защо и как се формират
Основните видове химически връзки: защо и как се формират Обикновени вещества
Обикновени вещества Комплексни връзки. Определение, класификация
Комплексни връзки. Определение, класификация Какво представлява водородната връзка? Видове, влияние
Какво представлява водородната връзка? Видове, влияние Кристалната решетка и нейните основни типове
Кристалната решетка и нейните основни типове Йонична кристална решетка
Йонична кристална решетка Метално свързване
Метално свързване Йонно свързване
Йонно свързване Характеристики на структурата на атомите на металите
Характеристики на структурата на атомите на металите Химическа връзка: определение, видове, класификация и характеристики на определението
Химическа връзка: определение, видове, класификация и характеристики на определението Ковалентната неполярна връзка е химична връзка, образувана от идентични атоми
Ковалентната неполярна връзка е химична връзка, образувана от идентични атоми