Какво представлява въглеродният окис? Структурата на молекулата
Въглеродният оксид, известен също като въглероден оксид, има много силен молекулен състав, има инертни свойства в химичните си свойства и слабо разтворим във вода. Това съединение също е невероятно токсично, когато влезе в дихателната система, то се комбинира с хемоглобина в кръвта и спира прехвърлянето на кислород в тъканите и органите.
съдържание
- Химични наименования и формула
- Ефекти върху тялото
- Токсичен газ
- Каква е употребата на въглероден окис?
- Химични свойства
- Молекулярна структура
- Малко история
- Окисление на въглероден окис
- Има ли co в природата?
- Молекулни свойства
- приемане
- Основни симптоми и помощ при отравянето с co
- приложение
- Въглероден моноксид и въглероден диоксид: каква е разликата?
Химични наименования и формула
Въглеродният окис е известен и под други имена, включително въглероден окис II. В ежедневието обикновено се нарича въглероден окис. Този въглероден моноксид е токсичен, безцветен и безвкусен газ, който е без мирис. Нейната химична формула е СО, а масата на една молекула е 28,01 g / mol.

Ефекти върху тялото
Въглеродният оксид се комбинира с хемоглобин, за да се образува карбоксихемоглобин, който няма кислороден капацитет. Вдишването на неговите пари причинява увреждане на централната нервна система (CNS) и задушаване. Получената липса на кислород причинява главоболие, замаяност, намален импулс и дихателна честота, което води до припадък и последваща смърт на тялото.

Токсичен газ
Въглеродният оксид се получава при частично изгаряне на вещества, съдържащи въглерод, например в двигатели с вътрешно горене. Съединението съдържа 1 въглероден атом, ковалентно свързан към 1 кислороден атом. Въглеродният оксид е много токсичен и това е една от най-честите причини за фатални отравяния по света. Експозицията може да доведе до увреждане на сърцето и други органи.
Каква е употребата на въглероден окис?
Въпреки сериозната си токсичност въглеродният окис е изключително полезен - благодарение на съвременната технология, от него се създават редица жизненоважни продукти. Въглеродният монооксид, въпреки че днес се счита за замърсител, винаги присъства в природата, но не и в такива количества, като въглероден диоксид.
Грешки са тези, които вярват, че в природата няма въглероден окис. CO се разтваря в разтопената вулканична скала при високи налягания в земната мантия. Съдържанието на въглеродни оксиди във вулканичните газове варира от по-малко от 0,01% до 2%, в зависимост от вулкана. Тъй като естественото от това съединение не е постоянна стойност, не е възможно точно измерване на емисиите на природен газ.

Химични свойства
Въглеродният окис (CO-формула) се отнася до окиси, които не образуват соли или неразтворими окиси. Въпреки това, при температура от +200 оС реагира с натриев хидроксид. По време на това химически процес образуване на натриев формиат:
NaOH + CO = HCOONa (сол на мравчената киселина).
Свойствата на въглеродния окис се основават на неговата редукционна способност. Въглероден монооксид:
- може да реагира с кислород: 2CO + O2 = 2 ° С2-
- е в състояние да реагира с халогени: СО + С12 = СОС12 (Фосген);
- има уникално свойство да извлича чисти метали от техните оксиди: Fe2О3 + 3CO = 2Fe + 3CO2-
- образува карбонили на метали: Fe + 5CO = Fe (CO)5-
- напълно разтворими в хлороформ, оцетна киселина, етанол, амониев хидроксид и бензен.

Молекулярна структура
Два атома, от които всъщност се състои въглеродният монооксид (СО) молекула, са свързани чрез тройна връзка. Два от тях са образувани чрез сливане на р-електрони с въглеродните атоми, с кислород, а третият - благодарение на специален механизъм поради свободен въглероден 2P орбитални и 2-р-електрон двойки кислород. Тази структура осигурява молекулата с висока якост.

Малко история
Дори Аристотел от древна Гърция описва токсичните изпарения, получени при изгарянето на въглища. Самият механизъм на смъртта не е бил известен. Един от древните методи на екзекуция обаче беше заключването на нарушаващия закон в парната баня, където се намират въглени. Гръцкият лекар Гален предложи да настъпят някои промени във въздуха, които причиняват вреда при вдишване.
През Втората световна война газова смес с примеси от въглероден окис се използва като гориво за моторни превозни средства в части от света, където имаше ограничено количество бензин и дизелово гориво. Външно (с някои изключения) се монтират генератори на въглен или дървен газ и смес от атмосферен азот, въглероден окис и малък брой други газове се подава в газов смесител. Това е така нареченият дървен газ.

Окисление на въглероден окис
Въглеродният оксид се образува чрез частично окисляване на съдържащи въглерод съединения. CO се образува, когато кислородът не е достатъчен за производството на въглероден диоксид (CO2), например, при работа на пещ или двигател с вътрешно горене в затворено пространство. Ако има кислород, както и някои други атмосферни концентрации, изгаряния от въглероден оксид, излъчващи синя светлина, образуват въглероден диоксид, известен като въглероден диоксид.
Въглищният газ, широко използван до 60-те години на миналия век за вътрешно осветление, готвене и отопление, има CO в своя състав като изгоден компонент на горивото. Някои процеси в съвременните технологии, като топенето на желязо, все още произвеждат въглероден окис като страничен продукт. Самото СО съединение се окислява в СО2 при стайна температура.
Има ли CO в природата?
Има ли въглероден моноксид в природата? Един от естествено срещащите се източници е фотохимичните реакции, възникващи в тропосферата. Тези процеси трябва да генерират около 5 × 1012 кг вещество е е-едно. Други източници, както вече споменахме, са вулканите, горските пожари и други видове изгаряния.
Молекулни свойства
Въглеродният монооксид има моларна маса 28,0, което го прави малко по-плътен от въздуха. Дължината на връзката между двата атома е 112,8 микрометра. Тя е достатъчно близка, че осигурява една от най-силните химически връзки. И двата елемента в СО съединението заедно имат около 10 електрона в една валентна черупка.
Като правило, в органичните карбонилни съединения се появява двойна връзка. характеристика характеристика на молекулата CO е фактът, че между атомите има силна тройна връзка с 6 общи електрона в 3 свързани молекулярни орбитали. Тъй като 4 от общите електрони произхождат от кислороден атом и само 2 от въглерода, един свързан орбитал е зает от два електрона от О2, формирайки дативна или диполна връзка. Това причинява поляризацията C Larr-O молекули с малък заряд ";" на въглерод и малък заряд на "+" за кислород.
Другите две свързани орбитали заемат една заредена частица от въглерод и една от кислорода. Молекулата е асиметрична: кислородът има по-голяма електронна плътност от въглерода и също така е леко позитивно зареден в сравнение с отрицателния въглерод.

приемане
В промишлеността производството на въглероден окис CO се осъществява чрез нагряване без достъп на въздух до въглероден диоксид или водна пара с въглища:
CO2 + С = 2СО;
Н2О + С = СО + Н2.
Последната получена смес се нарича още вода или синтетичен газ. При лабораторни условия, въглероден оксид II чрез излагане на органични киселини на концентрирана сярна киселина, която действа като дехидратиращ агент:
HCOOH = СО + Н2За;
Н2C2ох4 = СО2 + Н2О.
Основни симптоми и помощ при отравянето с CO
Има отравяне с въглероден окис? Да, и много силен. Отравянето с въглероден окис е най-честият феномен в целия свят. Най-честите симптоми са:
- усещане за слабост;
- гадене;
- виене на свят;
- умора;
- раздразнителност;
- лош апетит;
- главоболие;
- дезориентация;
- нарушено зрение;
- повръщане;
- припадъци;
- конвулсии.
Излагането на този токсичен газ може да доведе до значителни увреждания, които често водят до продължителни хронични патологични състояния. Въглеродният окис може да причини сериозно увреждане на плода на бременна жена. Жертвите, например, след пожар, трябва да получат незабавна помощ. спешно трябва да се обадите на линейка, да даде достъп до чист въздух, премахване на облекчение задух, спокойствие, топло. Тежкото отравяне, като правило, се третира само под наблюдението на лекари в болница.
приложение
Въглеродният оксид, както вече беше споменато, е токсичен и опасен, но е едно от основните съединения, използвани в съвременната индустрия за органичен синтез. СО се използва за производство на чисти метали, карбонили, фосген, въглероден диоксид, метилов алкохол, формамид, ароматни алдехиди, мравчена киселина киселина. Това вещество се използва и като гориво. Въпреки токсичността и токсичността си, тя често се използва като суровина за получаване на различни вещества в химическата промишленост.
Въглероден моноксид и въглероден диоксид: каква е разликата?
Моноксид и въглероден диоксид (CO и CO2) често се смесват помежду си. Двата газове са без мирис и безцветни, и двете имат отрицателен ефект върху сърдечно-съдовата система. И двата газове могат да навлязат в тялото чрез вдишване, кожа и очи. Тези съединения, когато са изложени на жив организъм, имат редица общи симптоми - главоболия, замаяност, гърчове и халюцинации. Повечето хора изпитват затруднения при определянето на разликата и не разбират, че изпусканията на автомобили излъчват CO и CO2 . Навътре, повишаването на концентрацията на тези газове може да бъде опасно за здравето и безопасността на лице, изложено на тях. Каква е разликата?
При високи концентрации и двете могат да бъдат фатални. Разликата е, че CO2 е общ природен газ, необходим за целия растителен и животински живот. CO не е често срещано явление. Това е вторичен продукт от изгарянето на аноксично гориво. Критичната химическа разлика е, че CO2 съдържа един въглероден атом и два кислородни атома, докато в СО има само един от тях. Въглеродният диоксид е незапалим, докато моноксидът има висока вероятност за запалване.
Въглеродният диоксид естествено се среща в атмосферата: хората и животните дишат кислород и издишват въглероден диоксид, т.е. живите същества могат да издържат в малки количества. Този газ също е необходим на растенията за фотосинтеза. Обаче въглеродният окис не възниква естествено в атмосферата и може да предизвика здравословни проблеми дори при ниски концентрации. Плътността на двата газове също е различна. Въглеродният диоксид е по-тежък и по-плътен от въздуха, докато въглеродният окис е леко по-светъл. Тази характеристика трябва да се има предвид при инсталиране на подходящи сензори в домовете.
 С кои съединения въглеродният оксид 4 реагира? Какви вещества реагира въглеродният диоксид?
С кои съединения въглеродният оксид 4 реагира? Какви вещества реагира въглеродният диоксид?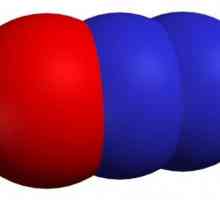 Азотен оксид (I, II, III, IV, V): свойства, производство, приложение
Азотен оксид (I, II, III, IV, V): свойства, производство, приложение Какво знаем за въглеродния диоксид?
Какво знаем за въглеродния диоксид? Въглероден монооксид: Формула и свойства
Въглероден монооксид: Формула и свойства Химия: оксиди, тяхната класификация и свойства
Химия: оксиди, тяхната класификация и свойства Ефектът на въглеродния оксид върху човешкото тяло. Помощ за отравяне с въглероден окис
Ефектът на въглеродния оксид върху човешкото тяло. Помощ за отравяне с въглероден окис Въглероден моноксид
Въглероден моноксид Основните химични свойства на въглеродния диоксид
Основните химични свойства на въглеродния диоксид Сяров оксид
Сяров оксид Въглероден диоксид
Въглероден диоксид Въглероден моноксид. Описание. Симптоми и последствия от отравяне
Въглероден моноксид. Описание. Симптоми и последствия от отравяне Общи характеристики и приложение на кислорода
Общи характеристики и приложение на кислорода Въглероден диоксид. Имоти, производство, приложение
Въглероден диоксид. Имоти, производство, приложение Кисел газ. Формула, производство, химични свойства
Кисел газ. Формула, производство, химични свойства Амфотерни оксиди. Химични свойства, производствен метод
Амфотерни оксиди. Химични свойства, производствен метод Калциев оксид. Физични, топлинни и химични свойства. Заявление.
Калциев оксид. Физични, топлинни и химични свойства. Заявление. Основни оксиди и техните свойства
Основни оксиди и техните свойства Киселинните оксиди включват неметални оксиди: примери, свойства
Киселинните оксиди включват неметални оксиди: примери, свойства Какво да правим с отравянето с въглероден окис, как да осигурим първа помощ?
Какво да правим с отравянето с въглероден окис, как да осигурим първа помощ? Въглероден диоксид, неговите физикохимични свойства и значение
Въглероден диоксид, неговите физикохимични свойства и значение Голямо градско отравяне с въглероден окис
Голямо градско отравяне с въглероден окис


