Въглероден моноксид
В резултат на непълно изгаряне на въглерод или продукти, които го съдържат, се образува въглероден оксид (СО) или въглероден окис. Други имена за този токсично вещество не като цвят и мирис (не е причинена от въглероден оксид, органични вещества и примеси), - въглероден оксид (II) или въглероден монооксид. Плътността му при 0 ° С е 0.00125 g / cmsup3 -. При температура минус 192 ° С преминава от газообразно до течно състояние и при -205 ° С - твърдо. Температурата на самозапалване е плюс 609 ° C. Оксид е слабо разтворим във вода (0.0026 грама в 100 мл), но разтворима в хлороформ, оцетна киселина, етилацетат, етанол, амониев хидроксид, бензен. Има моларна маса 28,0101 g / mol.
В допълнение към моноксида са известни и други въглеродни оксиди. Най - често срещаните от тях са въглероден диоксид или въглероден диоксид (СО2), който се получава в резултат на пълно изгаряне на въглерод (свободен или свързан). Това е безцветен газ с леко кисел вкус, но без мирис. Разтваря се добре във вода, което води до образуването на кисел въглероден моноксид СО (ОН) 2 или карбонова киселина H2CO3. Трикарбоновият диоксид (СЗО2) е токсичен газ без цвят, но с остър задушаващ мирис. При нормални условия лесно полимеризира, което води до продукти, които не се разтварят във вода и са боядисани в червено, жълто или лилаво. Съществуват и други въглеродни оксиди, които са по-малко известни и имат линейна или циклична структура. Формулите в тази серия варират от C2O2 до C32O8. В допълнение, има полимерно вещество, като графит оксид, молекула, съставена от С и изходни елементи и броя на двата атома може да варира.
Въглероден моноксид се получава като резултат от частично окисляване на въглерода (при условия на недостиг), за да се получи въглероден диоксид на кислород. Например, по време на работа на пещта или двигател с вътрешно горене в затворено пространство. В присъствието на кислород въглеродният оксид изгаря със син пламък, за да образува въглероден диоксид: 2CO + O2 → 2CO2. Кокс (или въглища) газ, който се използва широко за 60-те предходния век за вътрешно осветление, готвене и отопление, включени в състава си до 10% въглероден монооксид. Тъй като изгарянето на СО, голямо количество топлина, като газ е ценен компонент на гориво. Някои процеси в съвременните технологии (например чугун) все още се придружават от образуването на такива странични продукти, като въглероден окис. В най-голямата в света източник на въглероден окис естествен произход са фотохимични реакции, възникнали в тропосферата и генерират около 5 • 1012 кг годишно. Други естествени източници на въглероден оксид са вулкани, горски пожари и други горивни процеси.
От химическа гледна точка, въглеродният оксид се характеризира с намаляване на свойствата и склонност към свързване на реакциите. Но тези две тенденции се появяват само при повишени температури, при които въглеродният окис може да се комбинира с определени метали, хлор, кислород и сяра. В металургията способността на това вещество да загрява много оксиди до метали се използва при нагряване. При реакция с хлор се образува газ от фосген: СО + С12 harr-, COCI2. То е отровно, използвано в органичния синтез, постепенно може да се разложи с вода според реакционното уравнение: COCl2 + 2H2O → H2CO3 + 2HCl.
Въглеродният монооксид може да бъде директно свързан при повишена температура и под налягане до определени метали, за да се образуват карбонили на метали сложни съединения: Ni (CO) 4, Mo (CO) 6, Fe (СО) 5 и други. Въглеродният моноксид (II) може да реагира с амоняк върху катализатора (ториев оксид Th02) при 500 ° С, за да образува циановодород: СО + NH3 -> HCN + Н20.
Въглеродният оксид е токсично вещество за хора и животни. Токсичните свойства на въглероден окис, поради способността си да реагира необратимо с хемоглобина в кръвта, като по този начин губят способността да пренасят кислород към клетките и тъканите на тялото. Това означава, че възниква хипоксия от хемичен тип. В противен случай се нарича (поради намаляването на кислородния капацитет на кръвта) кръвта. Въглеродният монооксид (II) също участва в реакциите, нарушавайки биохимичното равновесие в тъканите на тялото. Лесно отравяне, придружено от главоболие, чукам на храмовете, замаяност, болки в гърдите, както и суха кашлица, сълзене на очите, гадене, повръщане, зрителни и слухови халюцинации, зачервяване на кожата и лигавиците, тахикардия, повишаване на налягането. В умерена сънливост и комплекти (при запазване на съзнанието) моторна парализа. Тежко отравяне се характеризира със симптоми като разширени зеници, загуба на съзнание, гърчове, кома, дихателна недостатъчност, неволно изпускане на изпражнения и урина, синкав кожата и лигавиците. Смъртта идва поради сърдечен арест и дишане.
 С кои съединения въглеродният оксид 4 реагира? Какви вещества реагира въглеродният диоксид?
С кои съединения въглеродният оксид 4 реагира? Какви вещества реагира въглеродният диоксид? Какво представлява въглеродният окис? Структурата на молекулата
Какво представлява въглеродният окис? Структурата на молекулата Какво знаем за въглеродния диоксид?
Какво знаем за въглеродния диоксид? Магнезиев оксид: свойства, производство, приложение
Магнезиев оксид: свойства, производство, приложение Въглероден монооксид: Формула и свойства
Въглероден монооксид: Формула и свойства Калциев хидроксид: свойства и приложения
Калциев хидроксид: свойства и приложения Основните химични свойства на въглеродния диоксид
Основните химични свойства на въглеродния диоксид Хлорен оксид
Хлорен оксид Сяров оксид
Сяров оксид Натриев оксид
Натриев оксид Въглероден диоксид
Въглероден диоксид Хром оксид
Хром оксид Въглероден моноксид. Описание. Симптоми и последствия от отравяне
Въглероден моноксид. Описание. Симптоми и последствия от отравяне Въглероден диоксид. Имоти, производство, приложение
Въглероден диоксид. Имоти, производство, приложение Кисел газ. Формула, производство, химични свойства
Кисел газ. Формула, производство, химични свойства Калциев оксид. Физични, топлинни и химични свойства. Заявление.
Калциев оксид. Физични, топлинни и химични свойства. Заявление. Основни оксиди и техните свойства
Основни оксиди и техните свойства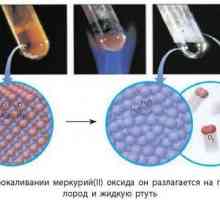 Окиси. Примери, класификация, свойства
Окиси. Примери, класификация, свойства Киселинните оксиди включват неметални оксиди: примери, свойства
Киселинните оксиди включват неметални оксиди: примери, свойства Въглероден диоксид, неговите физикохимични свойства и значение
Въглероден диоксид, неговите физикохимични свойства и значение Голямо градско отравяне с въглероден окис
Голямо градско отравяне с въглероден окис