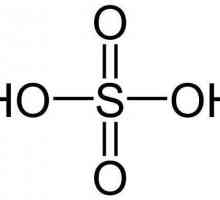
Разредена сярна киселина
Безцветна вискозна течност, точка на кипене което е 269.2 ordm-C и относителната тежест е 1.83 g / ml при температура на околната среда (20ordm-) - това е сярна киселина. Точката на топене на това вещество е само 10.3 одмм-С.
Ниво на концентрация сярна киселина в много отношения е определящ фактор за неговото приложение в химията и промишленото производство. По принцип се разграничават две основни условни разделения на нивата на концентрация, въпреки че в строго научен смисъл е невъзможно да се състави цифрова линия между тях. Съгласно тази класификация, се концентрират разредена сярна киселина и сярна киселина.
Взаимодействайки с редица метали, като желязо, цинк, магнезий, това вещество отделя водород по време на реакцията. Например, когато взаимодействаме с желязо, възниква реакция, чиято формула е написана, както следва: Fe + H2SO4 = FeSO4 + H2. Трябва да се помни, че разредената сярна киселина, чиито свойства я характеризират като най-силния окислител, практически не взаимодейства с метали с ниска активност - мед, сребро, злато.
Като силен окислител, това съединение може да окисли много голям списък от метали, това свойство определя широкото му приложение в различни области на индустриалното производство.
Като правило, при взаимодействие с реактивни вещества, например магнезий или натрий, в резултат на окислително-редукционната реакция, серен оксид (IV) и ако тези активни вещества са метали, реакцията произвежда сероводород (H2S) и сяра (S). Тези активни метали могат да бъдат калций, калий, вече споменати магнезий и други.
Безводна или наречена силно концентрирана сярна киселина, слабо или практически не взаимодейства с метали, например с желязо, защото желязото има изключително ниско ниво на химическа активност. Резултатът от тяхното взаимодействие може да бъде само образуването на повърхността на сплав, съдържащ желязо, силен филм, чийто химичен състав включва оксиди. Това се дължи на факта, че разредената сярна киселина и по-концентрирана се съхранява и транспортира главно в тара от метали: титан, алуминий, никел.
Това вещество е способно да окислява неметалите и дори да проявява своите окислителни свойства по време на реакциите със сложни вещества, които са редуктори. Характерът на протичането на такива реакции се определя от степента на концентрация, притежавана от разредена сярна киселина във всеки конкретен случай. От друга страна, това вещество, независимо от нивото на концентрация, има много характерни свойства, които другите киселини притежават. Например, чрез взаимодействие с оксиди, той може да доведе до изолиране на соли. Същото се случва и при взаимодействие с хидроксиди. В допълнение, разреден сярна киселина, формула който H2SO4 е двуосново съединение, което също така образува някои характерни свойства само за него при взаимодействие с други вещества. Основното нещо е, че в резултат на тези взаимодействия се образуват соли от два типа: средни (за концентрирани киселини) соли - сулфати и за разредени соли - соли на киселини, водородни сулфати.
Както вече беше отбелязано, разредената сярна киселина е важен и широко разпространен продукт на химическата промишленост. Приложението в други промишлени зони също е многостранно. Така че, той се използва в производството на изкуствени влакна и различни видове пластмаси, минерални торове, бои. Свойствата на киселината са в търсенето при производството взривни вещества. В металургичното производство е необходимо получаване на метали, и също широко се използва като газов изсушител.
Производствените продукти на сярна киселина - сулфати - се използват активно в селското стопанство, в промишлеността - в производството на бои, хартия, каучук, гипс и много други.
 Къде да закупите сярна киселина? Места за продажба и съвети
Къде да закупите сярна киселина? Места за продажба и съвети Азотна киселина
Азотна киселина Сярна киселина и нейната употреба
Сярна киселина и нейната употреба Производство на сярна киселина. Методи за приготвяне. приложение
Производство на сярна киселина. Методи за приготвяне. приложение Сярна киселина. Формула, свойства, производство и приложение
Сярна киселина. Формула, свойства, производство и приложение Натриев ацетат
Натриев ацетат Концентрирана сярна киселина в промишленото производство
Концентрирана сярна киселина в промишленото производство Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали
Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали Реакцията на взаимодействието на CaCl2, H2SO4
Реакцията на взаимодействието на CaCl2, H2SO4 Хлороводородна киселина
Хлороводородна киселина Хлорен оксид
Хлорен оксид Дехидратация на алкохоли
Дехидратация на алкохоли Силни киселини в ежедневието
Силни киселини в ежедневието Кисел газ. Формула, производство, химични свойства
Кисел газ. Формула, производство, химични свойства Сярна киселина. Химични свойства, производство
Сярна киселина. Химични свойства, производство Хидробромна киселина. Методи за приготвяне, физични и химични свойства
Хидробромна киселина. Методи за приготвяне, физични и химични свойства Сулфаминова киселина. Физични и химични свойства. приложение
Сулфаминова киселина. Физични и химични свойства. приложение Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа
Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа Химични свойства на киселините
Химични свойства на киселините Азотна киселина. Химични и физични свойства
Азотна киселина. Химични и физични свойства Каква е най-силната киселина?
Каква е най-силната киселина?