Концентрация и плътност на сярна киселина. Зависимост на плътността на сярната киселина от концентрацията в автомобилната батерия
Разредени и концентрирани сярна киселина
съдържание
- Процесът на дисоциация
- Свойства на сярната киселина
- Как концентрацията на разтворите като цяло
- Пример за преизчисляване на реализациите
- Използване на сярна киселина
- Плътността на сярна киселина и нейните сортове
- Как е батерията на автомобила
- Какво се случва с електролита, когато батерията се изтощи?
- Степени на изхвърляне на акумулаторна батерия в зависимост от плътността на електролита
- Мониторинг на електролита в батерията
Процесът на дисоциация
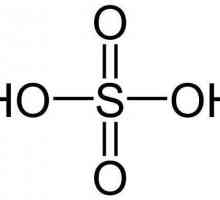
Сярна киселина се използва под формата на водни разтвори с различни концентрации. Той претърпява реакция на дисоциация на два етапа, като произвежда H+-йони в разтвор.
Н2SO4 = Н+ + HSO4- ;
HSO4- = Н + + SO4-2 .
Сярна киселина е силна и първият етап от нейната дисоциация е толкова силен, че почти всички родителски молекули се разпадат на Н+-йони и HSO4 -1 -йони (хидрогенсулфат) в разтвор. Последният частично се разпада допълнително, изолирайки другия Н+-йон и напускане на сулфатния йон (SO4-2 ) в разтвор. Все пак хидрогенсулфатът, който е слаба киселина, все още преобладава в разтвора над Н+ и SO4-2 . Неговата пълна дисоциация се получава само когато се приближава плътността на разтвора на сярна киселина плътност на водата, т.е. при силно разреждане.
Свойства на сярната киселина
Той е специален в смисъл, че може да действа като нормална киселина или като силен окислител - в зависимост от температурата и концентрацията му. Студеният разреден разтвор на сярна киселина реагира с активните метали, за да образува сол (сулфат) и отделя водороден газ. Например реакцията между студено разредена Н2SO4 (при предположението за неговата пълна двуетапна дисоциация) и металният цинк изглежда така:
Zn + H2SO4 =цинков4 + Н2.
Горещата сярна киселина се концентрира, чиято плътност е около 1,8 g / cm3, може да действа като окислител, като реагира с материали, които обикновено са инертни за киселини, като например метална мед. По време на реакцията, медта се окислява и киселинната маса намалява, разтвор меден сулфат (II) във вода и газообразен серен диоксид (SO2) вместо водород, което би било очаквано, когато киселината взаимодейства с метала.
Cu + 2H2SO4 = CuSO4 + SO2 + 2H2 О.
Как концентрацията на разтворите като цяло
Всъщност, концентрацията на всеки разтвор може да бъде изразена по различни начини, но най-широко използваната е концентрацията на теглото. Той показва количеството грамове разтворено вещество в определена маса или обем на разтвор или разтворител (обикновено 1000 g, 1000 cm3, 100 cm3 и 1 dm3). Вместо масата на материята в грамове, можете да вземете количеството, изразено в молове, - тогава моларна концентрация от 1000 g или 1 dm3 разтвор.
Ако моларната концентрация се определя по отношение не на количеството на разтвора, а само на разтворителя, той се нарича молалност на разтвора. Тя се характеризира с температурна независимост.
Често тегловната концентрация е посочена в грамове на 100 g разтворител. Умножавайки тази цифра със 100%, тя се получава като процент от теглото (процентна концентрация). Този метод най-често се прилага при прилагане на разтвори на сярна киселина.
Всяка стойност на концентрацията на разтвора, определена при дадена температура, съответства на много специфична плътност (например плътността на разтвор на сярна киселина). Ето защо понякога решението се характеризира с това. Например, разтвор на Н2SO4, характеризиращ се с процентна концентрация от 95,72%, има плътност от 1,835 g / cm3 при t = 20 ° С. Как да се определи концентрацията на такъв разтвор, ако се дава само плътността на сярна киселина? Таблица, даваща такава кореспонденция, е неразделна част от всеки учебник по обща или аналитична химия.
Пример за преизчисляване на реализациите
Нека се опитаме да се преместим от един от начините за изразяване на концентрацията на решението на друго. Да предположим, че имаме решение H2SO4във вода с процентна концентрация 60%. Първо, определете подходящата плътност на сярна киселина. Таблица, съдържаща процентите (първата колона) и съответните плътности на водния разтвор на Н2SO4 (четвърта колона) е показано по-долу.
На нея определяме желаната стойност, която е равна на 1,4987 g / cm3. Нека сега изчисляваме моларността на това решение. За тази цел е необходимо да се определи масата H2SO4в 1 литър разтвор и съответния брой молове на киселина.
Обемът, който заема 100 грама от основния разтвор:
100 / 1.4987 = 66.7 ml.
Тъй като в 66.7 милилитра от 60% разтвор съдържа 60 г киселина, в 1 литър той ще съдържа:
(60 / 66.7) х 1000 = 899, 55 g.
Молното тегло на сярна киселина е 98. Оттук броят на моловете, съдържащи се в 899,55 грама грама, ще бъде:
899.55 / 98 = 9.18 mol.
Зависимостта на плътността на сярната киселина от концентрацията е показана на Фиг. по-долу.
Използване на сярна киселина
Използва се в различни индустрии. При производството на желязо и стомана се използва за почистване на повърхността на метала, преди да се покрие с друго вещество, участва в създаването на синтетични багрила, както и други видове киселини като солна и азотна. Използва се и в производството на фармацевтични продукти, торове и експлозиви и също така е важен реагент при отстраняване на замърсяванията от нефт в нефтопреработвателната промишленост.
Това химично вещество е невероятно полезно в ежедневието и лесно се предлага като разтвор на сярна киселина, използван в оловно-киселинни акумулаторни батерии (например тези, които стоят в коли). Такава киселина, като правило, има концентрация от около 30% до 35% Н2SO 4 от теглото, балансът е вода.
За много домакински приложения, 30% H2SO4 ще бъде повече от достатъчно, за да отговори на техните нужди. В сектора обаче се изисква много по-висока концентрация на сярна киселина. Обикновено в производствения процес първо се получава достатъчно разреден и замърсен с органични включвания. Концентрираната киселина се получава на два етапа: първо се довежда до 70%, а след това - във втория етап - се повишава до 96-98%, което е ограничителният показател за икономически изгодно производство.
Плътността на сярна киселина и нейните сортове
Макар че почти 99% сярна киселина може да бъде получена за кратко при кипене, но последващата загуба на SO3 при температурата на кипене води до намаляване на концентрацията до 98,3%. По принцип сортът с индикатор 98% е по-стабилен при съхранение.
Стойностите на киселинните продукти се различават в процентната им концентрация и за тях се избират тези стойности, за които температурите на кристализация са минимални. Това се прави, за да се намали утаяването на кристалите сярна киселина в утайката по време на транспортиране и съхранение. Основните сортове са:
- Кула (нитроза) - 75%. Плътността на сярна киселина в този клас е 1670 кг / м3. Накарай го така наречен. нитрози, при който калцинираният газ, съдържащ серен диоксид SO2, в облицованите кули (оттам и името на сорта) се обработва с нитрози (това също е Н.2SO4, но с разтворени в него азотни оксиди). В резултат на това се отделят киселинни и азотни оксиди, които не се консумират в процеса, а се връщат към производствения цикъл.
- Контакт - 92,5-98,0%. Гъстотата на сярната киселина от 98% от този сорт е 1836.5 kg / m3. Също така се получава от калциниращ газ, съдържащ SO2, като процесът включва окисление на диоксида до S02 анхидрид3 с неговия контакт (оттам и името на сорта) с няколко слоя твърд ванадиев катализатор.
- Олеум - 104.5%. Плътността му е равна на 1896.8 кг / м3. Това решение SO3 в H2SO4, в който първият компонент съдържа 20%, а киселините - 104.5%.
- Олеум с голям интерес - 114,6%. Плътността му е 2002 кг / м3.
- Батерия - 92-94%.
Как е батерията на автомобила
Работата на това едно от най-масовите електротехнически устройства изцяло се основава на електрохимични процеси, протичащи в присъствието на воден разтвор на сярна киселина.
Батерията на автомобила съдържа разреден електролит от сярна киселина, както и положителни и отрицателни електроди под формата на няколко плочи. Положителните плочи са направени от червеникаво-кафяв материал - оловен диоксид (PbO2), и отрицателни - от сивкаво "гъбести" олово (Pb).
Тъй като електродите са направени от олово или съдържащи олово материал, този тип батерии често се нарича оловно-кисели батерии. Ефективността му, т.е. стойността на изходното напрежение, директно се определя от това, коя е текущата плътност на сярна киселина (kg / m3 или g / cm23), запълва акумулатора като електролит.
Какво се случва с електролита, когато батерията се изтощи?
Електролитът на оловно-киселата акумулаторна батерия е решение за съхраняване на сярна киселина в химически чиста дестилирана вода с процентно съдържание на концентрация 30% при пълно зареждане. Чистата киселина има плътност от 1,835 g / cm3, електролит - около 1300 г / см3. Когато акумулаторът се разреди, в него се получават електрохимични реакции, в резултат на което се взема сярна киселина от електролита. Плътността на концентрацията на разтвора зависи почти пропорционално, така че трябва да се намали поради намаляване на концентрацията на електролита.
Докато изтичащият ток протича през акумулатора, киселината близо до нейните електроди се използва активно и електролитът става по-разреден. Дифузията на киселината от обема на целия електролит и от електродните пластини поддържа приблизително постоянна интензивност на химичните реакции и вследствие на това изходното напрежение.
В началото на процеса на разтоварване дифузията на киселината от електролита в плочите се осъществява бързо, тъй като сулфатът, образуван по този начин, все още не запушва порите в активния материал на електродите. Когато сулфатът започне да се образува и запълва порите на електродите, дифузията се получава по-бавно.
Теоретично можете да продължите разреждането, докато се използва цялата киселина, а електролитът ще се състои от чиста вода. Опитът обаче показва, че изхвърлянето не трябва да продължава, след като плътността на електролита падне до 1,150 g / cm3.
Когато плътността намалява от 1300 до 1150, което означава, че много сулфат се образува по време на реакцията, и го изпълва всички пори в активния материал на плаките, т.е.. Е. От разтвора вече избран почти всички сярна киселина. Плътността зависи от концентрацията и натоварването зависи от плътността. На фиг. Зависимостта на заряда на акумулатора от плътността на електролита е показана по-долу.
Промяната на плътността на електролита е най-добрият начин да се определи състоянието на изхвърлянето на акумулатора, при условие че се използва правилно.
Степени на изхвърляне на акумулаторна батерия в зависимост от плътността на електролита
Плътността му трябва да се измерва на всеки две седмици и да се съхранява отчет за четене за бъдеща употреба.
Колкото по-плътен е електролитът, толкова повече киселина съдържа и толкова повече е заредена батерията. Плътността е 1300-1,280 g / cm3 показва пълно зареждане. Като правило, следните степени на разреждане на батерията се различават в зависимост от плътността на електролита:
- 1,300-1,280 - напълно заредено:
- 1,280-1,200 - повече от половината изпускани;
- 1,200-1,150 - по-малко от половината таксувани;
- 1,150 - практически изхвърлени.
За напълно заредена батерия, преди да свържете автомобилната мрежа, напрежението на всяка клетка е от 2,5 до 2,7 V. След като е свързано товара, напрежението пада бързо до около 2,1 V в продължение на три или четири минути. Това се дължи на образуването на тънък слой оловен сулфат върху повърхността на отрицателните електроди плочи и между слоя оловен пероксид и метала на положителните плочи. Крайната стойност на напрежението на клетката след свързването към автомобилната мрежа е около 2.15-2.18 волта.
Когато ток започва да тече през батерията по време на първия час на работа, има спад на напрежението на 2 V поради повишеното вътрешно съпротивление клетка поради образуването на по-големи количества сулфат който запълва порите на плаките и изборът на електролит киселина. Малко преди началото на изтичането плътност на тока Електролитът е максимален и равен на 1300 г / см3. Първоначално неговото изтъняване става бързо, но след това се установява балансирано състояние между плътността на киселината в близост до плочите и в главния обем на електролита, киселинната екстракция от електродите се поддържа от пристигането на нови части от киселината от главната част на електролита. В същото време, средната плътност на електролита продължава да намалява постоянно в зависимост от зависимостта, показана на Фиг. по-горе. След първоначалното пускане напрежението намалява по-бавно, скоростта на намаляването му зависи от натоварването на акумулатора. Часовата графика на процеса на разреждане е показана на Фиг. по-долу.
Мониторинг на електролита в батерията
За определяне на плътността се използва плътност. Състои се от малка запечатана стъклена тръба с удължение в долния край, изпълнено с изстрел или живак и градуирана скала в горния край. Тази скала е маркирана от 1100 до 1300 с различни междинни стойности, както е показано на фиг. по-долу. Ако този хидрометър е поставен в електролита, той ще падне до определена дълбочина. В този случай той ще измести определен обем електролит и когато равновесното положение бъде достигнато, теглото на изместения обем просто ще бъде равно на теглото на хидрометъра. Тъй като плътността на електролита е равна на съотношението на теглото му към обема и теглото на хидрометъра е известно, всяко ниво на потапянето му в разтвора съответства на определена плътност.  Някои самериметри нямат скала с стойности на плътността, но са обозначени като "Заредени", "Полуизпускане", "Пълно отвеждане" или други подобни.
Някои самериметри нямат скала с стойности на плътността, но са обозначени като "Заредени", "Полуизпускане", "Пълно отвеждане" или други подобни.
 Къде да закупите сярна киселина? Места за продажба и съвети
Къде да закупите сярна киселина? Места за продажба и съвети Дисоциация на соли, киселини и основи. Теория и практическо приложение
Дисоциация на соли, киселини и основи. Теория и практическо приложение Каква е разпадането на водата?
Каква е разпадането на водата? Степен на дисоциация на слаби и силни електролити
Степен на дисоциация на слаби и силни електролити Концентрация на мола. Каква е моларната и молалната концентрация?
Концентрация на мола. Каква е моларната и молалната концентрация? В какви случаи дисоциационната константа няма смисъл?
В какви случаи дисоциационната константа няма смисъл? Сярна киселина и нейната употреба
Сярна киселина и нейната употреба Производство на сярна киселина. Методи за приготвяне. приложение
Производство на сярна киселина. Методи за приготвяне. приложение Сярна киселина. Формула, свойства, производство и приложение
Сярна киселина. Формула, свойства, производство и приложение Разредена сярна киселина
Разредена сярна киселина Концентрирана сярна киселина в промишленото производство
Концентрирана сярна киселина в промишленото производство Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали
Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали Реакцията на взаимодействието на CaCl2, H2SO4
Реакцията на взаимодействието на CaCl2, H2SO4 Силни киселини в ежедневието
Силни киселини в ежедневието Буферни разтвори: подготовка и използване
Буферни разтвори: подготовка и използване Сярна киселина. Химични свойства, производство
Сярна киселина. Химични свойства, производство Хидробромна киселина. Методи за приготвяне, физични и химични свойства
Хидробромна киселина. Методи за приготвяне, физични и химични свойства Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа
Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа Химични свойства на киселините
Химични свойства на киселините Приготвяне на сярна киселина и нейното приложение.
Приготвяне на сярна киселина и нейното приложение. Електрическа дисоциация: теоретични основи на електрохимията
Електрическа дисоциация: теоретични основи на електрохимията