Истинските решения са какво? Свойства и състав
В природата почти не се случва чисти вещества.
съдържание

Характеристики на истински решения
Истинските решения са вид дисперсни системи с голяма якост между дисперсионната среда и дисперсната фаза.
Всяко химично вещество може да произвежда кристали с различни размери. Във всеки случай, те ще имат една и съща вътрешна структура: йонна или молекулярна кристална решетка.
разтваряне
По време на разтварянето на зърна от натриев хлорид и захар във вода се образува йонен и молекулярен разтвор. В зависимост от степента на фрагментация, веществото може да бъде във формата:
- видими макроскопични частици, чийто размер е по-голям от 0,2 mm;
- микроскопични частици с размер по-малък от 0,2 mm, те могат да бъдат улавяни само с помощта на микроскоп.
Истинските и колоидните разтвори се различават по размера на частиците на разтвореното вещество. Невидимите кристали се наричат колоидни частици в микроскоп и полученото състояние се нарича колоиден разтвор.

Фаза на разрешаване
В много случаи истинските решения са дезинтегрирани (диспергирани) системи с хомогенна форма. Те съдържат непрекъсната непрекъсната фаза - дисперсионната среда и натрошени частици с определена форма и размер (дисперсна фаза). Каква е разликата между колоидните разтвори и истинските системи?
Основната разлика е в размера частици. Colloid-диспергира системите се считат за хетерогенни, тъй като е невъзможно да се открие интерфейсът между фазите в светлинния микроскоп.
Истинските решения са опция, когато в околната среда веществото е представено като йони или молекули. Те се отнасят до еднофазни хомогенни решения.
Като предпоставка за образуване на дисперсни системи се разглежда взаимното разтваряне на дисперсионната среда и диспергиращото се вещество. Например, натриев хлорид и захарозата са неразтворими в бензол и керосин, следователно в такъв разтворител няма да се образуват колоидни разтвори.

Класификация на дисперсни системи
Как се разделят разпръснатите системи? вярно разтвори, колоидни системите се различават в няколко параметъра.
Съществува подразделение на диспергираните системи над агрегатното състояние на средата и диспергираната фаза, образуването или отсъствието на взаимодействие между тях.
характеристики на
Има определени количествени характеристики на дисперсията на материята. На първо място, степента на дисперсия се отличава. Тази стойност е обратната на размера на частиците. Той характеризира броя на частиците, които могат да се поставят на ред на разстояние от един сантиметър.
В случая, когато всички частици имат едни и същи размери, се образува монодисперсова система. С неидентични частици от дисперсната фаза се образува полидисперсова система.
С увеличаването на дисперсността на материята процесите, които се появяват в интерфазната повърхност, се увеличават. Например, специфичната повърхност на диспергираната фаза се увеличава, физикохимичните ефекти на средата на интерфейса между двете фази се увеличават.

Варианти на дисперсни системи
В зависимост от фазата, в която ще бъде разположено разтвореното вещество, се изолират различни варианти на дисперсни системи.
Аерозолите са диспергирани системи, в които дисперсната среда е представена в газообразна форма. Мъглата са аерозоли, които имат течна дисперсна фаза. Димът и прахът образуват твърда дисперсна фаза.
Пяните са дисперсия в течността на газообразно вещество. Течностите в пеновете се дегенерират до филми, които отделят газови мехурчета.
Емулсиите се наричат дисперсни системи, където една течност се разпределя в обем от друга, без да се разтваря в нея.
Суспензиите или суспензиите са системи с ниска дисперсия, в които твърдите частици са в течност. Колоидни разтвори или соли с водна дисперсна система се наричат хидрозоли.
В зависимост от наличието (отсъствието) между частиците на диспергираната фаза се изолират свободно диспергирани или кохезивни диспергирани системи. Първата група включва лизозоли, аерозоли, емулсии, суспензии. В такива системи няма контакти между частиците и дисперсионната фаза. Те са свободни да се движат в разтвор под влиянието на гравитацията.
Кохерентни системи се срещат в случай на контакт на частици с дисперсна фаза, в резултат на което се образуват структури под формата на решетка или рамка. Такива колоидни системи се наричат гелове.
Процесът на желиране (желиране) е превръщането на солта в гел, базирано на понижаване на стабилността на началния сол. Примери за кохезивни диспергирани системи са суспензии, емулсии, прахове, пени. Те включват и почвата, образувана по време на взаимодействието на органични (хуминови) вещества и почвени минерали.
Капилярно-дисперсните системи се характеризират с непрекъсната маса вещество, проникващо в капилярите и порите. Те разглеждат тъкани, различни мембрани, дърво, картон, хартия.
Истинските решения са хомогенни системи, състоящи се от два компонента. Те могат да съществуват в разтворители, различни в агрегатното състояние. Разтворителят се счита за вещество, взето в излишък. Компонент, взет в недостатъчни количества, се счита за разтворено вещество.

Характеристики на решения
Твърдите сплави са също решения, при които различни метали действат като диспергирани среди и компоненти. От практическа гледна точка от особен интерес са течните смеси, в които течността действа като разтворител.
От многото неорганични разтворители водата е от особен интерес. Практически винаги се създава истинският разтвор, когато частиците на разтвореното вещество се смесват с вода.
Сред органичните съединения, следните разтворители са отлични разтворители: етанол, метанол, бензен, въглероден тетрахлорид, ацетон. Поради хаотичното движение на молекулите или йоните на разтворения компонент се осъществява частичен преход към разтвора, образуването на нова хомогенна система.
Веществата се различават в способността си да образуват разтвори. Някои могат да се смесват помежду си в неограничени количества. Пример за това е разтварянето във вода на кристали с настолна сол.
Същността на процеса на разтваряне от гледна точка на молекулярко-кинетичната теория е, че след въвеждането на кристали на натриев хлорид в разтворителя, той се дисоциира в натриеви катиони и хлорни аниони. Заредените частици вибрират, сблъсъци с частиците на самия разтворител водят до прехода на йони в разтворителя (свързването). Постепенно други частици са свързани с процеса, повърхностният слой се разрушава, соленият кристал се разтваря във вода. Дифузията дава възможност да се разпределят частиците на веществото по обема на разтворителя.

Видове истински решения
Истинското решение е система, която е разделена на няколко вида. Съществува класификация на такива системи за вода и неводни по вид разтворител. Те също така се класифицират според варианта на разтвореното вещество за алкали, киселини, соли.
Има различни видове истински решения по отношение на електрически ток: нелектролити, електролити. В зависимост от концентрацията на разтвореното вещество те могат да бъдат разредени или концентрирани.
Истинските решения на нискомолекулните вещества от термодинамична гледна точка са разделени на реални и идеални.
Такива разтвори могат да бъдат йонно-диспергирани, както и молекулярно-дисперсни системи.

Насищане на разтвори
В зависимост от това колко от частиците преминават в разтвора, има свръхнаситени, ненаситени, наситени разтвори. Разтворът е течна или твърда, хомогенна система, която се състои от няколко компонента. Във всяка такава система има задължително разтворител, както и разтворено вещество. С разпадането на някои вещества се отделя топлина.
Подобен процес потвърждава теорията на решенията, според които разпадането се разглежда като физикохимичен процес. Има подразделение на процеса на разтворимост в три групи. Първият е съставен от тези вещества, които могат да се разтварят в количество от 10 g на 100 g разтворител, те се наричат добре разтворими.
Веществата се считат за слабо разтворими, ако в 100 g от компонента се разтварят по-малко от 10 g, други се наричат неразтворими.
заключение
Системи, състоящи се от различни в агрегатно състояние, размери на частиците, са необходими за нормална човешка дейност. Истинските колоидни разтвори, разгледани по-горе, се използват за производството на лекарства, за създаване на хранителни продукти. Имайки представа за концентрацията на разтвореното вещество, можете самостоятелно да подготвите необходимия разтвор, например етилов алкохол или оцетна киселина, за различни цели в ежедневието. В зависимост от състоянието, в което разтворимото вещество и разтворителят са в агрегатно състояние, получените системи имат определени физични и химични характеристики.
 Брауново движение: обща информация.
Брауново движение: обща информация. Чисти вещества: примери. Приготвяне на чисти вещества
Чисти вещества: примери. Приготвяне на чисти вещества Как да растем кристали от сол и други вещества?
Как да растем кристали от сол и други вещества? Формулата на солта е кулинарията. Химична формула: сол за трапеза. Свойства на масата за сол
Формулата на солта е кулинарията. Химична формула: сол за трапеза. Свойства на масата за сол Концентрация на мола. Каква е моларната и молалната концентрация?
Концентрация на мола. Каква е моларната и молалната концентрация? Клей във вода се разтваря или не. Разтворимост на различни вещества
Клей във вода се разтваря или не. Разтворимост на различни вещества Хетерогенно равновесие
Хетерогенно равновесие Хомогенни смеси: определение на понятието, състав, примери
Хомогенни смеси: определение на понятието, състав, примери Видове решения. Видове концентрация на разтвора
Видове решения. Видове концентрация на разтвора Разтвори: концентрация, масова фракция. Дефиниция, изчисления и препоръки
Разтвори: концентрация, масова фракция. Дефиниция, изчисления и препоръки Видове кристални решетки от различни вещества
Видове кристални решетки от различни вещества Разтворимост на веществата: таблица. Разтворимост на веществата във вода
Разтворимост на веществата: таблица. Разтворимост на веществата във вода Какви вещества се наричат чисти: определението на понятия и примери
Какви вещества се наричат чисти: определението на понятия и примери Фазата на разсейване е какво?
Фазата на разсейване е какво? Дисперсни системи: общи характеристики и класификация
Дисперсни системи: общи характеристики и класификация Обикновени вещества
Обикновени вещества Кристалната решетка и нейните основни типове
Кристалната решетка и нейните основни типове Йонична кристална решетка
Йонична кристална решетка Колоидна частица: определение, характеристики, видове и свойства
Колоидна частица: определение, характеристики, видове и свойства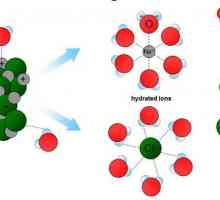 Истинското решение: определение, атрибути, състав, свойства, примери
Истинското решение: определение, атрибути, състав, свойства, примери Колоидни разтвори - нова дума в медицината
Колоидни разтвори - нова дума в медицината