Карбид: формула, приложение и свойства
Много химични съединения са известни в света: около стотици милиони. И всички, като хората, са индивидуални. Не можете да намерите две вещества, които имат същите химични и физични свойства за различни състави.
съдържание
Едно от най-интересните неорганични вещества, съществуващи в света, е карбидите. В тази статия ще разгледаме тяхната структура, физични и химични свойства, приложението и анализирането на детайлите на тяхното производство. Но първо, малко за историята на откритието.

история
Карбидите от метали, формулите, които ще дадем по-долу, не са естествени съединения. Това се дължи на факта, че техните молекули са склонни да се разпадат, когато взаимодействат с водата. Ето защо тук си струва да се говори за първите опити за синтезиране на карбиди.
От 1849 г. се споменават синтеза на силициев карбид, но някои от тези опити остават неразпознати. Широкомащабното производство започва през 1893 г. от американския химик Едуард Ахесън по начин, който по-късно носи името му.
Историята на синтеза на калциев карбид също не е много различна. През 1862 г. получава немски химик Фридрих Вьолер, загряващ цинк и калций с въглища.
Сега нека да преминем към по-интересни раздели: химични и физични свойства. В крайна сметка те са същността на приложението на този клас вещества.

Физични свойства
Абсолютно всички карбиди се различават по тяхната твърдост. Например, един от най-много скалата на Мос е волфрамов карбид (9 от 10 възможни точки). В допълнение, тези вещества са много огнеупорни: точката на топене на някои от тях достига две хиляди градуса.
Повечето карбиди са химически инертни и взаимодействат с малко количество вещества. Те не са разтворими в разтворители. Взаимодействието с вода обаче може да се разглежда като разтваряне, с разрушаването на връзките и образуването на хидроксид на метал и въглеводород.
Последната реакция и много други интересни химични трансформации, включващи карбиди, ще бъдат разгледани в следващия раздел.

Химични свойства
Почти всички карбиди реагират с вода. Някои са лесни и без отопление (например, калциев карбид), и някои (например силициев карбид) - когато водната пара се нагрява до 1800 градуса. Реактивността в този случай зависи от естеството на връзката в съединението, за което ще говорим по-късно. При реакцията с вода се образуват различни въглеводороди. Това се случва, защото водородът, който се съдържа във водата, е свързан с въглерода в карбида. За да се разбере какво се случва въглеводород (както може да се случи като ограничаване и ненаситеното съединение), е възможно, въз основа на валенцията на въглерода, съдържащ се в изходния материал. Например, ако имаме калциев карбид, чиято формула е CaC2, ние виждаме, че съдържа йон С22-. Следователно, два водородни йони с заряд + могат да бъдат прикрепени към него. По този начин получаваме съединението С2Н2 - ацетилен. По същия начин, от съединение като алуминиев карбид, формулата, от която Al4C3, получаваме CH4. Защо не C3Н12, питаш ли? В крайна сметка, йонът има заряд от 12-. Фактът е, че максималният брой водородни атоми се определя от формулата 2n + 2, където п е броят на въглеродните атоми. Следователно, може да съществува само съединение с формула С3Н8 (пропан) и този йон с натоварване от 12 - се разпада на три йона с заряд от 4, което те дават, когато се комбинират с протоните на метановата молекула.
Интересни са окислителните реакции на карбидите. Те могат да се получат както под въздействието на силни окислителни смеси, така и при обикновено изгаряне в кислородна атмосфера. Ако с кислород всичко е ясно: два оксида са получени, а с други окислители е по-интересно. Всичко зависи от природата на метала, който е част от карбида, както и от характера на окислителя. Например, силициевият карбид, чиято формула е SiC, при взаимодействие със смес от азотни и азотни съединения флуороводородна киселина образува хексафлуоросилициева киселина с освобождаването на въглероден диоксид. И когато провеждаме същата реакция, но само с азотна киселина, получаваме силициев оксид и въглероден диоксид. Окислителите могат също така да включват халогени и халкогени. С тях всеки карбид взаимодейства, реакционната формула зависи само от структурата му.
Металните карбиди, чиито формули сме разгледали, в никакъв случай не са единствените представители на този клас съединения. Сега ще разгледаме по-отблизо всяка индустриално значима комбинация от този клас и след това ще говорим за тяхното приложение в нашия живот.

Какво представляват карбидите?
Оказва се, че карбид, чиято формула, казват, CaC2 съществено се различава в структурата от SiC. И разликата е преди всичко в природата на връзката между атомите. В първия случай, ние имаме работа със сол като карбид. Този клас съединения е наречен така, защото се държи всъщност като сол, т.е. е способен да се разпада на йони. Такава йонна връзка е много слаба, което я прави лесна за провеждане реакция на хидролиза и много други трансформации, включващи взаимодействия между йоните.
Друг вероятно по-важен вид карбид са ковалентните карбиди, като например SiC или WC. Те се характеризират с висока плътност и сила. Както и огнеупорни и инертни за разреждане на химикали.
Има и метални карбиди. Те могат да се считат за сплави на метали с въглерод. Сред тях можем да различим например цементий (железен карбид, чиято формула варира, но средно е приблизително една и съща: Fe3C) или чугун. Те имат междинна химична активност в степента си между йонни и ковалентни карбиди.
Всеки от тези подвидове от класа химически съединения, които обсъждаме, има практическо приложение. За това как и къде се прилага всеки от тях, ще говорим в следващия раздел.

Практическо приложение на карбиди
Както вече обсъдихме, ковалентните карбиди имат най-голям набор от практически приложения. Този абразивни или рязане на материали, както и композитни материали, използвани в различни области (например, като един от материалите, съдържащи бронежилетката), и автомобилни части и електронни инструменти и нагревателните елементи и ядрената енергия. И това далеч не е пълен списък на приложенията на тези суперхидридни карбиди.
Най-тясно е използването на сол-образуващи карбиди. Реакцията им с вода се използва като лабораторен метод за производство на въглеводороди. Начинът, по който се случва, ние вече демонтирахме по-горе.
Заедно с ковалентните метални карбиди имат най-широко приложение в индустрията. Както вече казахме, такъв метален тип от съединенията, които обсъждаме, са стомани, отливки и други метални съединения с импрегниране на въглерод. Като правило металът, съдържащ се в такива вещества, принадлежи към класа на d-металите. Ето защо той е склонен да не образува ковалентни връзки, а да проникне в структурата на метала.
По наше мнение, има повече от достатъчно практически приложения за гореспоменатите съединения. Сега нека разгледаме процеса на тяхното получаване.
Производство на карбиди
Първите два вида карбиди които считат, а именно ковалентна и saltlike получат най един прост начин: чрез взаимодействие оксид на елемент и кокс при високи температури. В същото време част от кокса, състоящ се от въглерод, се комбинира с атома на елемента в оксида и образува карбид. Другата част "взима" кислород и образува въглероден окис. Този метод е много енергийно интензивен, тъй като изисква поддържане на висока температура (около 1600-2500 градуса) в реакционната зона.
За да се получат някои видове съединения, се използват алтернативни реакции. Например, разлагане на съединението, което в крайна сметка дава карбид. Реакционната формула зависи от конкретното съединение, така че няма да го обсъждаме.
Преди да завършим статията си, ще обсъдим някои интересни карбиди и ще говорим по-подробно за тях.
Интересни съединения
Натриев карбид. Формулата за това съединение С2Na2. Това може да бъде повече като ацетиленид (т.е. продукт на заместване на водородни атоми в ацетилен за натриевите атоми), а не карбид. Химическата формула не отразява напълно тези тънкости, така че те трябва да се търсят в структурата. Той е много активно вещество и при всеки контакт с вода взаимодейства много активно с него, за да образува ацетилен и алкали.
Магнезиев карбид. Формула: MgC2. Методите за получаване на това достатъчно активно съединение са интересни. Един от тях предполага синтероване на магнезиев флуорид с калциев карбид при висока температура. В резултат на това се получават два продукта: калциев флуорид и карбидът, от който се нуждаем. Формулата за тази реакция е съвсем проста и можете, ако искате, да я прочетете в специализирана литература.
Ако не сте сигурни за полезността на материала в статията, тогава следващата секция е за вас.

Как може това да бъде полезно в живота?
Е, на първо място, познаването на химичните съединения никога не може да бъде излишно. Винаги е по-добре да бъдете въоръжени с знание, отколкото да останете без него. Второ, повече знаете за съществуването на определени съединения, толкова по-добре да се разберат механизмите на тяхното образуване и законите, които им позволяват да съществува.
Преди да стигна до края, бих искал да дам някои препоръки относно изучаването на този материал.

Как да изучаваме това?
Това е много просто. Това е само част от химията. И трябва да се изучава според учебниците по химия. Започнете с информацията за училището и отидете на по-задълбочено, от учебниците и справочните книги на университета.
заключение
Тази тема не е толкова проста и скучна, колкото изглежда на пръв поглед. Химията винаги може да стане интересна, ако откриете, че това е цел.
 Калциев карбид
Калциев карбид Какво представлява сложно вещество? Как се случва това?
Какво представлява сложно вещество? Как се случва това? Физични свойства на протеините. Най-важните химични свойства на протеините
Физични свойства на протеините. Най-важните химични свойства на протеините Уникални физични и химични свойства на водата
Уникални физични и химични свойства на водата Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества
Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества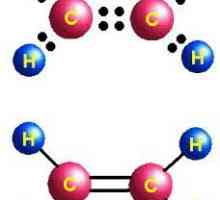 Първият представител на алкени е етилен. Физични свойства, производство, приложение на етилен
Първият представител на алкени е етилен. Физични свойства, производство, приложение на етилен Органичните вещества имат своите характеристики и класификация
Органичните вещества имат своите характеристики и класификация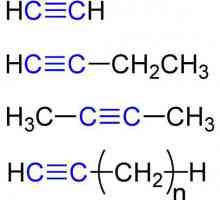 Химични свойства на алкините. Структура, приемане, приложение
Химични свойства на алкините. Структура, приемане, приложение Циклични наситени въглеводороди: как се произвеждат. циклоалкани
Циклични наситени въглеводороди: как се произвеждат. циклоалкани Къде да намерим карбид? Какви предпазни мерки са необходими?
Къде да намерим карбид? Какви предпазни мерки са необходими? Неорганични вещества
Неорганични вещества Хидридите са ... Използването на хидриди
Хидридите са ... Използването на хидриди Основни хидроксиди и техните химични свойства
Основни хидроксиди и техните химични свойства Органични съединения и тяхната класификация
Органични съединения и тяхната класификация Хидробромна киселина. Методи за приготвяне, физични и химични свойства
Хидробромна киселина. Методи за приготвяне, физични и химични свойства Азотна киселина. Химични и физични свойства
Азотна киселина. Химични и физични свойства Химични свойства на бази
Химични свойства на бази Химични свойства на солите и методи за тяхното получаване
Химични свойства на солите и методи за тяхното получаване Неорганични вещества: примери и свойства
Неорганични вещества: примери и свойства Алуминиев карбид
Алуминиев карбид Монохидратни алкохоли, техните физични и химични свойства
Монохидратни алкохоли, техните физични и химични свойства