Какво представлява коагулацията? Праг на коагулация. Правила за коагулация на електролитите
Колоидната химия е науката за дисперсионни системи и повърхностни явления, възникващи на интерфейсите на фазите, а основната й теория е коагулацията. Прагът на коагулация зависи от много фактори. Колоидната химия освен това изследва адсорбцията, адхезията, омокрянето и други явления в дисперсните системи. Тази статия ще бъде посветена на една от секциите, която въпреки всичко е тясно свързана с останалите.
съдържание

коагулация
Какво представлява коагулацията? Преведено от латински, това е коагулацията, кондензацията, комбинацията от малки частици в дисперсните системи и тяхното преобразуване в по-големи като резултат от сцеплението, процес, който се прилага еднакво за химията и физиката. Така се формират коагулационните структури. Тази теория е конструиран както следва: има дисперсната фаза, където частиците са в брауново движение (независимо) до момента, когато две частици не са по-близо до разстояние, при което техните центрове могат да бъдат определени като радиуса на сферата на влияние (означен с г).
Това разстояние е приблизително равна на сумата от радиуса на частиците, и директен контакт е неизбежна, тъй като внезапно (незабавно скок) изглежда сили взаимодействия, частиците са привлечени един към друг и агрегиран. Вероятността за сблъсък на повече от две частици е незначителна и поради това привлича единична или двойна единична или двойна частица помежду си, тройна с единична и т.н. Оттук започва теорията за химичните бимолекулни реакции. Това е коагулация. Прагът на коагулация води до утаяване в колоиден разтвор под формата на флоски (люспи), или получавате желе.

дефиниция
Какво е коагулацията като процес - за да разберете, че е възможно, сега е необходимо да се извлече определението. Коагулацията е намаляване на степента на дисперсия, както и броят на частиците чрез залепване. Резултатът е утаяване на дисперсираната фаза (т.е. загубата на частици) или всякакви промени в първоначално представената дисперсна система. Човек може да наблюдава в природата как възниква спонтанна коагулация. Това е стареене на колоиден разтвор (sol) с деламиниране в диспергирана среда и твърда фаза с постигане на минимална енергия. Но човечеството може изкуствено да причини коагулация с помощта на коагуланти (специални реактиви).
Прагът на коагулация е по-малко количество електролит, достатъчен за започване на процеса на утаяване. Неговите структури се наричат коагулация. Те се образуват, ако разпръснатата система загуби стабилността си на утаяване. Достатъчно съдържание на диспергираната фаза осигурява усилване на пълния обем на цялата дисперсна система. Цялата течна среда обаче не може да "втвърди", колоидната дисперсна фаза обикновено е много малка, няколко процента от общата маса.
свойства
Силата на коагулационната структура не е твърде висока, механичните ефекти могат да предизвикат спонтанно възстановяване в диспергирана подвижна среда. Това свойство (тиксотропия) има полимери, лакове, бои, където се образуват коагулационни структури поради пигменти и пълнители. Най-характерният пример са пространствените решетки, които възникват в дисперсии на глини, когато се коагулират с електролити.
Устойчивостта на утаяване е противодействаща на утаяването на частиците, които са доста тежки, но не се установяват под въздействието на гравитацията. Това се случва във всички грубо диспергирани системи, които могат да бъдат проследени чрез примесите на утайка в суспензии и сметана в емулсии, където чиста дисперсионна среда и слой от дисперсионната фаза са разделени на слой. За утаяване, два типа са типични: бавно утаяване и бързо. В първия случай, частиците не се прилепват, утаяват се отделно, а във втория се утаяват заедно. Първият случай показва устойчивост на утаяване, а вторият показва нестабилност.

Проблемът със стабилността
Всеки разбира стабилността на способността да запази оригиналния състав в непостоянството. Същото се случва в процеса на коагулация. Прагът на коагулация нарушава това състояние. Тогава времето на постоянната концентрация на диспергираната фаза завършва и постоянното разпределение на частиците в нея. В колоидната химия един от основните проблеми е животът или смъртта, които са избрани за себе си чрез дисперсни системи. Тези задачи са обратното и те трябва да бъдат решени почти постоянно. Например запазването или унищожаването на дисперсна система.
Ако тази храна маса - е необходимо да се запази своята стабилност, и ако вода от всички водни тела - стабилност трябва да бъдат унищожени, почистване. Тоест, да се утаят всички лоши примеси. Или, например, масло - тяхната дисперсна фаза се състои от сложни сумомолекулни образувания, които се разделят на независима микрофаза като частици с различни размери. И тук разпръснатите системи са най-широкото поле на действие.
остаряване
Скоростта на стареене на колоидалната зол зависи от много фактори: разделяне на фазите, коефициентът на дифузия на радиуса на частиците, и macrophase температурата разтворимост. Електрокоагулацията е ускоряването на стареенето, когато електролитът се коагулира. Сблъсъците на частици не винаги причиняват сливане, защото са обградени от двоен електрически слой, напротив, отблъсквайки ги един от друг.
С помощта на електролити, този слой може да бъде унищожен или деформиран, като по този начин ускорява коалесценцията. Типът на електролита, т.е. лиотропната серия от йони, валентността на електролита влияе върху ефективността на този процес. Хидрофобните соли могат да се разпаднат, ако електролитите се добавят постепенно. Това стана обект на огромен брой теоретични и експериментални произведения.

йони
Ефектът на електролитите върху състоянието на хидрофобния сол показва, че коагулиращото действие зависи от йонния заряд. Коефициентът на коагулация значително се повишава при концентрация на електролита, която надвишава критичната стойност (това е прагът на коагулацията). Формулата му се изчислява, ако концентрацията на коагулатора (електролит) -С е известна, обема на добавения електролит V, както и общия обем на сол-V30 (обикновено десет милиграма). Големината противопоставя праг коагулация, е капацитетът коагулиране на електролита, а долният праг на съсирване, толкова по-голяма възможност на електролита, за да коагулира.
Въпреки това, не всички електролита участва в този процес, тук главният герой е само един от елементите на един йон, който съвпада с техния знак отговаря и на стойността на врага (и йонен заряд, призова за коагулация на дейност, винаги е противоположна на таксата, която е с колоидно частици). Този йон се нарича йонен коагулант. И колкото повече е неговата такса, толкова по-висока е коагулиращата способност, според правилото Шулзе-Гарди. Връзката между йонния коагулант и прага на коагулация е описана в теорията Deryagin-Landau. Правилата за коагулация на електролитите включват правилото за стойността относно съотношението на праговете на коагулация за моновалентни, двувалентни и тривалентни йони. Y1 : Y.2 : Y.3 = 729: 11: 1. Това означава, че три бит йон може да коагулира 729 пъти по-бързо от едноцифрения йон.

модификации
С течение на времето и във връзка с развитието на колоидната химия като наука, определени отклонения са установени в правилото на ценността. Прагът на коагулация зависи не само от заряда, но и от радиуса на коагулантния йон и от способността му да хидратира и абсорбира, както и от самата същност на йон, който съпътства коагулатора. Мулти-зарядният йон дава ефект на обмен на заряд на частици, т.е. ако знакът за зареждане се промени, потенциалът на колоидните частици също се променя.
Добавените йони се обменят с противойони, замествайки ги в адсорбционните и дифузните слоеве. Ако многократно зареденият йон е малък, като Al3+, Th4+ и други, се получава супереквивалентна адсорбция, когато този йон замества зареждането на несъответстващия брой на предишните йони върху повърхността на частиците. И тогава, например, вместо един или два йона К+ се оказва, че е Th4+. Това показва промяната в потенциала и знака на таксата.

физика
Колоидната смес е стабилна, ако електростатичното отблъскване и стеричните ефекти я помагат. Ето защо методът на коагулиращ е както следва: електростатичното отблъскване се предотвратява чрез промяна на рН или добавяне на сол, поради което колоидни частици са в състояние да се движат близо до това разстояние, което е необходимо за тяхното залепване.
Целта на коагулацията е образуването на флокулентни клъстери, което е необходимо, например, за утаяване или филтриране на водата. Само ако люспите достигнат достатъчно голям размер, те могат да бъдат премахнати. И без коагулация, това е изключително непрактично, тъй като отнема огромно количество време. Оптималният размер на флокуланти за пречистване на водата, например, трябва да бъде няколко милиметра, в противен случай е почти невъзможно да се отстранят примесите.
Процесът
Коагулацията има два етапа:
1. Химикалът бързо се смесва с вода - около една минута, така че коагулантът да е правилно разпределен и да не разрушава формираните флокули. Обикновено се използва специален смесител-резервоар за смесване.
2. От половин час до четиридесет и пет минути всъщност се извършва коагулация, Когато водата, минаваща през няколко резервоара с намаляваща скорост на смесване, образува утайка.
Отделен случай е, когато коагулацията се извършва от електролити, където два хидрофобни зола имат различни признаци на зареждане. В случая на конвенционална коагулация, коагулационните йони участват в презареждането и в този случай е необходимо известно съотношение на смесване на разтворените смеси, за да се позволи това презареждане да се осъществи.
стойност
Взаимното коагулиране е много важно както в природните, така и в технологичните процеси. Например, образуването на почвения хоризонт се дължи на коагулацията на почвени електролити от почвени колоиди. Солите във вода се хидролизират колоидни частици, положително заредена, -А1(ОН)3, които взаимодействат с колоидни частици във вода, които почти винаги са отрицателно заредени, което води до взаимно коагулиране, след което се утаяват коагулираните частици.
Най-ефективната коагулация е, когато към диспергираната система се добавят електролити, съдържащи йони с противоположна заряд, като по този начин се елиминира устойчивостта на утаяване. За електролитни коагулационни процеси се използват железни или алуминиеви соли, както и техни смеси. Коагулацията може да бъде причинена по различни начини - от механични ефекти до промени в температурата. Ако водата, например, кипи или замръзне, се образува утайка. Също така се отразяват на процеса на коагулация различни радиация, добавянето на чужди вещества, особено електролити. Това е коагулацията на електролита, която е най-важна и следователно добре проучена и широко използвана.

Електролитна коагулация
Както вече беше споменато, електролитната коагулация се появява най-ясно в колоидни системи, където стабилизаторът е йонен и стабилността се осигурява в най-висока степен чрез електростатично отблъскване на колоидни частици. Оттук може да се заключи, че заедно с действието на електролита, електростатичното отблъскване на частиците намалява и частиците се оставят да се слепват заедно.
Дори при не много висока концентрация на електролити, колоидните разтвори започват процеса на коагулация - бавен или бърз. Но много често е необходимо да се създаде защита на стабилността на солите, като се създават адсорбционни слоеве на повърхността на частиците, при които структурните и механичните свойства се увеличават. По този начин е възможно да се спре напълно или да се предотврати коагулацията на електролита чрез просто добавяне на разтвор от високомолекулни съединения - натриев казеинат, желатин, яйчен албумин или други подобни.
 Брауново движение: обща информация.
Брауново движение: обща информация. Коагулаграма - какво е това? Декодиране на кръвната коагулаграма: показатели и норма
Коагулаграма - какво е това? Декодиране на кръвната коагулаграма: показатели и норма Кръвен тест. Съсирване на кръвта. Декодиране на кръвния тест: коагулация
Кръвен тест. Съсирване на кръвта. Декодиране на кръвния тест: коагулация Протромбинов индекс, норма и стойност
Протромбинов индекс, норма и стойност Ензимът, който причинява съсирване на кръвта, казват те?
Ензимът, който причинява съсирване на кръвта, казват те? Радио вълнова коагулация на шийката на матката: ефекти и обратна връзка
Радио вълнова коагулация на шийката на матката: ефекти и обратна връзка Хетерогенно равновесие
Хетерогенно равновесие Как да се увеличи кръвосъсирването?
Как да се увеличи кръвосъсирването? Истинските решения са какво? Свойства и състав
Истинските решения са какво? Свойства и състав Хемостатични агенти
Хемостатични агенти Органична и физиколоидна химия: описание, задачи и особености
Органична и физиколоидна химия: описание, задачи и особености Брауново движение: определение. Брауново движение - какво е това?
Брауново движение: определение. Брауново движение - какво е това?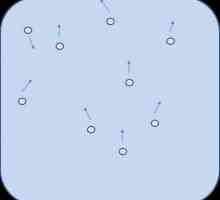 Фазата на разсейване е какво?
Фазата на разсейване е какво? Съсирване на кръвта, норма и отклонение от него
Съсирване на кръвта, норма и отклонение от него Коагулаграма: норма и отклонение
Коагулаграма: норма и отклонение Оттеглянето е ... Определение. Отдръпване на кръвния съсирек
Оттеглянето е ... Определение. Отдръпване на кръвния съсирек Дисперсни системи: общи характеристики и класификация
Дисперсни системи: общи характеристики и класификация Молекулярна физика
Молекулярна физика Колоидна частица: определение, характеристики, видове и свойства
Колоидна частица: определение, характеристики, видове и свойства Основни сектори на химията: описание, характеристики и интересни факти
Основни сектори на химията: описание, характеристики и интересни факти Лазерната коагулация е високоефективно лечение с максимална безопасност на пациента
Лазерната коагулация е високоефективно лечение с максимална безопасност на пациента