Зависимост на скоростта на реакцията спрямо температурата. Уравнението на Arrhenius
Ние постоянно се сблъскваме с различни химични взаимодействия. Изгаряне на природен газ, ръждясване на желязо, накисване на мляко - не всички процеси, които са изучени в детайли в училищния курс по химия.
съдържание
- Значението на разглеждания въпрос
- Класификация на текущите реакции
- Математическата връзка между скоростта на процеса и различните фактори
- Фактори, влияещи върху скоростта на химическата реакция
- отопление
- Графично представяне
- Важни аспекти
- Измерване на скоростта на процеса
- Инхибитори и катализатори
- заключение
Някои реакции изискват фракции от секунди, а някои взаимодействия изискват дни и седмици.
Нека се опитаме да определим зависимостта на скоростта на реакцията от температурата, концентрацията, други фактори. В новия образователен стандарт този въпрос се отнася до минималното време за обучение. В тестовете на единния държавен изпит има задачи за зависимостта на скоростта на реакцията от температурата, концентрацията и дори задачите за изчисление. Много ученици в гимназията изпитват известни трудности при намирането на отговори на тези въпроси, така че ще анализираме тази тема подробно.

Значението на разглеждания въпрос
Информацията за скоростта на реакцията е от голямо практическо и научно значение. Например, при специфичното производство на вещества и продукти от определена стойност, производителността на оборудването, стойността на стоките, зависи пряко.
Класификация на текущите реакции
Съществува пряка връзка между агрегираното състояние на първоначалните компоненти и продуктите, образувани по време на химичен процес: хетерогенни взаимодействия.
В системата е обичайно да се предполага веществото или комбинацията от тях в химията.
Хомогенна разглежда такава система, която се състои от една фаза (същото агрегатно състояние). Като пример можем да споменем смес от газове, няколко различни течности.
Хетерогенна е система, в която реактантите са под формата на газове и течности, твърди частици и газове.
Има не само зависимостта на скоростта на реакцията от температурата, но и фазата, в която се използват компонентите, влизащи в анализираното взаимодействие.
За хомогенен състав процесът протича през целия обем, което значително подобрява неговото качество.
Ако изходните материали са в различни фазови състояния, тогава максималното взаимодействие се наблюдава при фазовата граница. Например, когато активният метал се разтваря в киселина, образуването на продукта (солта) се наблюдава само на контактната повърхност.

Математическата връзка между скоростта на процеса и различните фактори
Какво е уравнението на зависимостта на скоростта на химическата реакция от температурата? За хомогенен процес скоростта се определя от количеството вещество, което влиза в взаимодействието или се образува по време на реакцията в обема на системата за единица време.
За хетерогенен процес скоростта се определя от количеството вещество, което реагира или се получава в процеса на единица площ за минимален период от време.

Фактори, влияещи върху скоростта на химическата реакция
Естеството на реагиращите вещества е една от причините за различната скорост на процесите. Например алкалните метали образуват алкали с вода при стайна температура и процесът се придружава от интензивно отделяне на водороден газ. Благородните метали (злато, платина, сребро) не са способни на такива процеси нито при стайна температура, нито при нагряване.
Естеството на реагиращите вещества е факторът, който се взема предвид в химическата промишленост, за да се увеличи рентабилността на производството.
Открита е зависимостта между концентрацията на реагентите и бързината на химичната реакция. Колкото е по-високо, толкова повече частици ще се сблъскат, затова процесът ще продължи по-бързо.
Законът за действащите маси в математическа форма описва пряко пропорционална връзка между концентрацията на първоначалните вещества и скоростта на процеса.
Той е формулиран в средата на деветнадесети век от руския химик NN Beketov. За всеки процес се определя реакционна константа, която не е свързана с температурата, концентрацията или естеството на реагентите.
За да се ускори реакцията, в която е включено твърдото вещество, е необходимо да се пречисти на прахообразно състояние.
Това увеличава площта, която оказва положително влияние върху скоростта на процеса. За дизелово гориво се използва специална система за впръскване, така че при контакт с въздуха скоростта на изгаряне на смес от въглеводороди се увеличава значително.

отопление
Зависимостта на скоростта на химичната реакция от температурата се обяснява с молекулярно-кинетичната теория. Той дава възможност да се изчисли броят на сблъсъците между реагентните молекули при определени условия. Ако се въоръжите с такава информация, тогава при нормални условия всички процеси трябва да започнат незабавно.
Но ако разгледаме конкретен пример за зависимостта на скоростта на реакцията от температурата, се оказва, че за взаимодействието е необходимо първо да се прекъснат химическите връзки между атомите, така че от тях да се образуват нови вещества. Това изисква значително количество енергия. Каква е зависимостта на скоростта на реакцията от температурата? Енергията на активиране определя възможността за молекулно разкъсване, а именно, характеризира реалността на процесите. Неговите единици за измерване са kJ / mol.
Ако енергийният индекс е недостатъчен, сблъсъкът ще бъде неефективен, така че не е придружен от образуването на нова молекула.

Графично представяне
Зависимостта на химичната реакционна скорост от температурата може да бъде представена графично. При нагряване броят на сблъсъците между частиците се увеличава, което спомага за ускоряване на взаимодействието.
Как графиката на скоростта на реакцията зависи от температурата? Енергията на молекулите се полага хоризонтално и броят на частиците с висок енергиен резерв е посочен вертикално. Графиката е крива, от която може да се прецени скоростта на конкретно взаимодействие.
Колкото по-голяма е разликата в енергията от средната, толкова по-голяма е точката на кривата от максимума, а по-малкият процент молекули има такова количество енергия.

Важни аспекти
Възможно ли е да се напише уравнението на зависимостта на константата на скоростта на реакцията спрямо температурата? Увеличението отразява увеличаването на скоростта на процеса. Тази зависимост се характеризира с определена стойност, наречена температурен коефициент на скоростта на процеса.
За всяко взаимодействие се установява, че скоростта на реакцията зависи от температурата. Ако се увеличи с 10 градуса, скоростта на процеса се увеличава с фактор 2-4.
Зависимостта на скоростта на хомогенни реакции върху температурата може да бъде представена в математическа форма.
За повечето взаимодействия при стайна температура коефициентът е в диапазона от 2 до 4. Например, при температурен коефициент 2,9, повишаване на температурата от 100 градуса ускорява процеса почти 50 000 пъти.
Зависимостта на скоростта на реакцията от температурата може лесно да се обясни с различни стойности на енергията на активиране. Той има минимална стойност при извършване на йонни процеси, които се определят само от взаимодействието на катиони и аниони. Многобройни експерименти показват моменталното възникване на такива реакции.
При висока стойност на енергията за активиране, само малък брой сблъсъци между частиците ще доведе до взаимодействие. При средна енергия на активиране реагентите ще взаимодействат със средната скорост.
Заданията на зависимостта на скоростта на реакцията от концентрацията и температурата се разглеждат само в по-високия стадий на обучение, често предизвикват сериозни затруднения за децата.
Измерване на скоростта на процеса
Тези процеси, които изискват значителна енергия за активиране, предполагат първоначално разкъсване или отслабване на връзките между атомите в изходните материали. В същото време те влизат в определено междинно състояние, наречено активиран комплекс. Това е нестабилно състояние, разтваря се доста бързо в реакционни продукти, процесът се придружава от освобождаване на допълнителна енергия.
В най-проста форма, активираният комплекс е конфигурация от атоми с отслабени стари връзки.

Инхибитори и катализатори
Нека анализираме зависимостта на скоростта на ензимната реакция от температурата на средата. Такива вещества действат като ускорители на процеса.
Самите те не са участници в взаимодействието, но броят им остава непроменен след приключването на процеса. Ако катализаторите допринасят за увеличаване на реакционната скорост, тогава инхибиторите, напротив, забавят този процес.
Същността на това е образуването на междинни съединения, в резултат на което се наблюдава промяна в скоростта на процеса.
заключение
В света всяка минута има различни химични взаимодействия. Как да се установи зависимостта на скоростта на реакцията от температурата? Уравнението на Arrhenius е математическо обяснение на връзката между скоростта и температурата. Тя дава представа за тези стойности на енергията на активиране, при които е възможно разрушаването или отслабването на връзките между атомите в молекулите, разпределението на частиците в нови химически вещества.
Благодарение на молекулярната кинетична теория е възможно да се предскаже вероятността от взаимодействия между първоначалните компоненти и да се изчисли скоростта на процеса. Сред факторите, които влияят върху скоростта на реакцията, са особено важни промените в температурния индекс, процентната концентрация на взаимодействащите вещества, контактната повърхност, наличието на катализатор (инхибитор) и естеството на взаимодействащите компоненти.
 Реакция на съединението: Примери и формула
Реакция на съединението: Примери и формула Химическо равновесие: константата на химическото равновесие и начините на неговото изразяване
Химическо равновесие: константата на химическото равновесие и начините на неговото изразяване Дифузия на твърди вещества, течности и газове: определение, условия
Дифузия на твърди вещества, течности и газове: определение, условия Какво означава, ако се увеличи скоростта на утаяване на еритроцитите?
Какво означава, ако се увеличи скоростта на утаяване на еритроцитите? Хетерогенни или хетерогенни системи
Хетерогенни или хетерогенни системи Принцип Le Chatelier: научен пробив на 18 век
Принцип Le Chatelier: научен пробив на 18 век Хомогенни реакции.
Хомогенни реакции. Активен център на ензима: структура, свойства. Кой откри активния център на ензима? Какво се нарича…
Активен център на ензима: структура, свойства. Кой откри активния център на ензима? Какво се нарича… Поликондензацията е ... Реакция на поликондензация: пример, свойства и приемане
Поликондензацията е ... Реакция на поликондензация: пример, свойства и приемане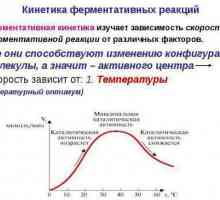 Кинетика на ензимните реакции - описание, характеристики и таблица
Кинетика на ензимните реакции - описание, характеристики и таблица Какъв е топлинният ефект на реакцията
Какъв е топлинният ефект на реакцията Как протича реакцията на изгаряне?
Как протича реакцията на изгаряне? Активна енергия
Активна енергия Фактори, влияещи върху скоростта на химическата реакция
Фактори, влияещи върху скоростта на химическата реакция Примери за окислително-редукционни реакции с разтвор. OVR: схеми
Примери за окислително-редукционни реакции с разтвор. OVR: схеми Как да уредим коефициентите в химическите уравнения? Химични уравнения
Как да уредим коефициентите в химическите уравнения? Химични уравнения Химическо равновесие: какво е да се промени
Химическо равновесие: какво е да се промени Каква е каталитичната реакция? Основни принципи и видове
Каква е каталитичната реакция? Основни принципи и видове Ред на реакция: концепция, видове
Ред на реакция: концепция, видове Химичното равновесие е основата на обратимите химични реакции
Химичното равновесие е основата на обратимите химични реакции Уравнение на химичните реакции - запис на условна химическа реакция
Уравнение на химичните реакции - запис на условна химическа реакция