Хомогенни реакции.
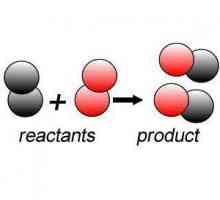
Както е известно, на химическа реакция е превръщането на вещество, което обикновено се нарича източник на друг, което ще се различава от това има химически състав и структура. В първия случай те говорят за реагентите, а във втория случай говорят за реакционни продукти. Това е известно на всички останали от курса на училищната химия. Също разбира училище химия известен фактът, че по време на такава реакция не променя състава на химични елементи, в този случай, само разпределение на ядра и електрони, в резултат на нови химикали, образувани.
всички химични реакции могат да бъдат разделени на класове. Заслужава си да отбележим първо хомогенни реакции. Това са реакции, които се случват в една фаза. Хомогенните реакции, примери за които са също така лесно да се намери във всеки учебник по химия, предполага различни потоци homolytic реакции се характеризират с разлагането на молекули в радикали, заместване и елиминиране, пренареждане, и така нататък. И това се случва, като правило, в течната фаза. Speed хомогенна реакция, ако количеството вещество остават постоянни, ще зависи от закона за действието на масите. Хомогенните реакции, наблюдавани между реагентите, които първоначално са в различни фази, става възможно само при условие, че дифузията ще се случи между тях. Тогава скоростта на реакцията също ще се увеличи значително. Ако дифузията на изходните материали ще бъде бавно, на много хомогенна реакция се извършва на граничната повърхност между фазата на дифузия. Всички функции на тези реакции и техните механизми ще зависи от условията, при които реагентите ще действат.
Скорост на реакция ще зависи от определени фактори, като естеството на веществата, които влизат в реакцията, тяхната концентрация, температурата, при която реакцията протича, и наличието на определен катализатор в нея. Той помага на реакцията да протича с по-висока скорост и с по-малко енергия на активиране. По отношение на концентрацията на веществата е ясно, че колкото повече вещества ще реагират, толкова повече те ще се сблъскат и в резултат на това скоростта на реакцията ще се увеличи.
Ярък пример за хомогенна система може да бъде всяка смес от газове. Всички газове при повишена температура ще се разтварят в големи количества един в друг. Това важи и за смес от азот и кислород. Може да се даде още един пример, показващ хомогенната реакция. Това не е нищо повече от воден разтвор, съдържащ натриев хлорид, магнезиев сулфат, азот и кислород. В този случай системата преминава само в една фаза. Ако реакцията протича в хомогенна система, тя продължава по целия обем. Ако, например, източване и с разбъркване разтвор на сярна киселина и натриев тиосулфат ще настъпи помътняване. Това ще се дължи на сяра, която ще се появи в целия обем на разтвора.
По време на тази или тази хомогенна реакция се отделя определено количество топлина. Топлинният ефект на реакцията Това ще зависи от размера на реагенти в реакцията и взети от които продукти са получени чрез реакцията. Въпросът колко бързо хомогенната реакция ще продължи ще зависи от интервала от време, в който се провежда. Цялата наука е ангажирана с изясняване на тези въпроси. Тя се нарича "кинетика". Най-важното е постулатът, че за появата на молекула реакции, които участват в него, трябва винаги да бъде в контакт един с друг. Не всеки такъв контакт обаче може да доведе до химическа реакция. Хомогенна реакции - само тези, в които частиците на потока намокрени ще имат резерв от енергия, която ще надхвърли стойността на прага.
 Реакция на съединението: Примери и формула
Реакция на съединението: Примери и формула Реакция на разпадане: примери и уравнение
Реакция на разпадане: примери и уравнение Реакцията на съединението. Примери за реакция на съединение
Реакцията на съединението. Примери за реакция на съединение Хетерогенните реакции са прости и разбираеми!
Хетерогенните реакции са прости и разбираеми! Качествени реакции към органични вещества, аниони, катиони
Качествени реакции към органични вещества, аниони, катиони Хетерогенни или хетерогенни системи
Хетерогенни или хетерогенни системи Химия: оксиди, тяхната класификация и свойства
Химия: оксиди, тяхната класификация и свойства Хомогенна система
Хомогенна система Каталитични реакции: примери. Хомогенна и хетерогенна катализа
Каталитични реакции: примери. Хомогенна и хетерогенна катализа Какво е OVR в съвременната химия?
Какво е OVR в съвременната химия? Химически уравнения: как да се реши най-ефективно
Химически уравнения: как да се реши най-ефективно Качествени реакции
Качествени реакции Химични реакции: защо алхимиците са погрешни
Химични реакции: защо алхимиците са погрешни Видове химични реакции
Видове химични реакции Химия в човешкия живот
Химия в човешкия живот Класификация на химическите реакции
Класификация на химическите реакции Фактори, влияещи върху скоростта на химическата реакция
Фактори, влияещи върху скоростта на химическата реакция Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията
Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията Каква е каталитичната реакция? Основни принципи и видове
Каква е каталитичната реакция? Основни принципи и видове Ред на реакция: концепция, видове
Ред на реакция: концепция, видове Химичното равновесие е основата на обратимите химични реакции
Химичното равновесие е основата на обратимите химични реакции