Ковалентна връзка
За първи път за такава концепция като ковалентна връзка химици говориха след откритието на Гилбърт Нютън Луис, който описа химическо свързване като социализация на два електрона. По-нови изследвания са направили възможно описването на самия принцип на ковалентно свързване. Думата ковалентна може да се разглежда в рамките на химията като способността на един атом да образува връзки с други атоми.
Нека да обясним с един пример:
Съществуват два атома с незначителни разлики в електронегретивността (С и CL, С и Н). Като правило това е така атомите, структурата на електронната обвивка който е най-близо до структурата на електронната обвивка на благородни газове.
Когато тези условия са изпълнени, възниква привличането на ядрата на тези атоми към електронната двойка, която е обща за тях. В този случай електронните облаци не се наслагват един върху друг, както в йонно свързване. Ковалентна връзка осигурява сигурна връзка на двата атома от факта, че електронната плътност се преразпределя и енергията на системата се променя, което е причинено от "прибиране" в пространството internuclear един електронен облак от друг атом. Колкото по-широко е взаимното припокриване на електронните облаци, връзката се счита за по-солидна.
От тук, ковалентна връзка - тази формация, която възниква чрез взаимната социализация на два електрона, принадлежащи на два атома.
Като правило вещества с решетка от молекулярни кристали се образуват чрез ковалентна връзка. Характеристика за молекулна структура са топене и кипене при ниски температури, лоша разтворимост във вода и ниска електрическа проводимост. От това можем да заключим, че структурата на такива елементи като германий, силиций, хлор, водород е ковалентна връзка.
Имоти, които са специфични за този тип връзка:
- Насищане. Това свойство обикновено се разбира като максималния брой връзки, които могат да установят специфични атоми. Това количество се определя от общия брой на тези орбитали в атома, които могат да участват в образуването на химични връзки. Валентността на един атом, от друга страна, може да се определи от броя на вече използваните орбитали за тази цел.
- насоченост. Всички атоми са склонни да формират най-силните връзки. Най-голяма сила се постига в случай на съвпадение на пространствената ориентация на електронните облаци от два атома, тъй като те се припокриват. В допълнение, това е свойството на ковалентната връзка като насоченост, която засяга пространственото подреждане на молекулите органична материя, т.е. той е отговорен за тяхната "геометрична форма".
- Поляризуемост. В основата на тази разпоредба е идеята, че ковалентната връзка съществува в две форми:
- полярен или небалансиран. Връзка от този тип може да образува само атоми от различни видове, т.е. тези, чиято електронегативност е значително различна, или в случаите, когато общата електронна двойка е асиметрично разделена.
- неполярна ковалентна връзка възниква между атомите, чиято електронегодност е практически равна и разпределението на електронната плътност е еднаква.
Освен това има определени количествени характеристиките на ковалентната връзка:
- Силата на комуникацията. Този параметър характеризира полярното свързване по отношение на силата му. С енергия се има предвид количеството топлина, което е необходимо, за да се прекъсне връзката между два атома, както и количеството топлина, което е било освободено по време на свързването им.
- под дължина на съединителяи в молекулярната химия се разбира дължината на права линия между ядрата на два атома. Този параметър също характеризира силата на връзката.
- Двойният момент - стойност, която характеризира полярността на валентната връзка.
 Как да се определи полярността на връзката? Поляризация напред и назад
Как да се определи полярността на връзката? Поляризация напред и назад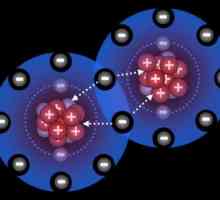 Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор?
Механизъм на донор-акцептор: примери. Какво представлява механизъм донор-акцептор?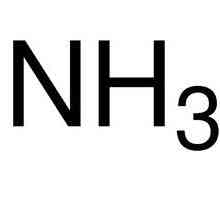 Определете валентността на химичните елементи
Определете валентността на химичните елементи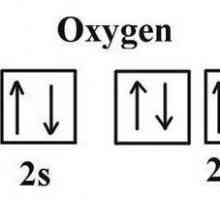 Каква е кислородната валентност в съединенията?
Каква е кислородната валентност в съединенията?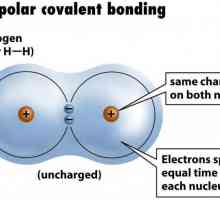 Пример за неполярна ковалентна връзка. Ковалентна връзка полярна и неполярна
Пример за неполярна ковалентна връзка. Ковалентна връзка полярна и неполярна Донор-акцепторна връзка: примери за вещества
Донор-акцепторна връзка: примери за вещества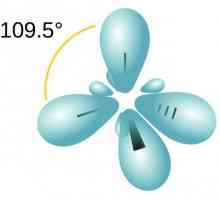 Нека да поговорим за това как да определим вида на хибридизацията
Нека да поговорим за това как да определим вида на хибридизацията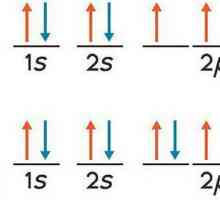 Каква е електронната конфигурация на калий
Каква е електронната конфигурация на калий Как да определим валентността
Как да определим валентността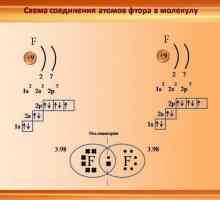 Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка
Характеристики на ковалентната връзка. За кои вещества е ковалентна връзка Основните видове химически връзки: защо и как се формират
Основните видове химически връзки: защо и как се формират Атомна кристална решетка
Атомна кристална решетка Какво представлява водородната връзка? Видове, влияние
Какво представлява водородната връзка? Видове, влияние Йонична кристална решетка
Йонична кристална решетка Какво е ковалентна полярна връзка
Какво е ковалентна полярна връзка Метално свързване
Метално свързване Йонно свързване
Йонно свързване Накратко за комплекса: структурата на електронните черупки на атомите
Накратко за комплекса: структурата на електронните черупки на атомите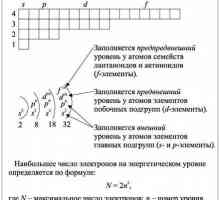 Външни енергийни нива: структурни особености и ролята им в взаимодействието между атомите
Външни енергийни нива: структурни особености и ролята им в взаимодействието между атомите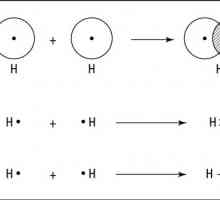 Предметът и задачите на химията. Обща химия. Органична химия
Предметът и задачите на химията. Обща химия. Органична химия Химическа връзка: определение, видове, класификация и характеристики на определението
Химическа връзка: определение, видове, класификация и характеристики на определението