Характеристики на калий. Структурата на калий. Калиеви съединения
Тази статия ще даде описание на калия по отношение на физиката и химията. Първата от тези науки изследва механичните и външните свойства на веществата. И второто - тяхното взаимодействие помежду си - това е химията. Калий - деветнадесетият елемент на сметката в периодичната таблица. Той принадлежи на алкални метали.
съдържание
- Характеризиране на калия по отношение на физиката
- Калий и химия
- Взаимодействие с прости вещества
- Взаимодействие със сложни вещества
- Калий и вода
- Реакции с киселини
- Калий и оксиди
- Взаимодействие с бази
- Реакции със соли
- Реакции с мазнини
- Използването на калий и неговите съединения
- Подготовка на разглеждания метал
- Структурата на калий
- Къде можете да намерите този елемент в природата?
- Ролята на калия в организма, симптомите на липса и излишък
- Храна с високо съдържание на въпросния микроелемент
- заключение
Характеризиране на калия по отношение на физиката
Това е просто вещество, което при нормални условия е в твърдо агрегатно състояние. Точката на топене е 60 градуса по Целзий. Същият метал се загрява, когато температурата достигне седемстотин шестдесет и един градус по Целзий. Разглежданото вещество има сребристо-бял цвят. Има метален блясък.  Плътността на калий е осемдесет и шест стотни от грам на сантиметър кубичен. Това е много лек метал. Формулата на калий е много проста - тя не образува молекули. Това вещество се състои от атоми, които са разположени близо един до друг и имат кристална решетка. Атомната маса на калий е равна на тридесет и девет грама на мол. Твърдостта му е много ниска - лесно може да бъде изрязана с нож като сирене.
Плътността на калий е осемдесет и шест стотни от грам на сантиметър кубичен. Това е много лек метал. Формулата на калий е много проста - тя не образува молекули. Това вещество се състои от атоми, които са разположени близо един до друг и имат кристална решетка. Атомната маса на калий е равна на тридесет и девет грама на мол. Твърдостта му е много ниска - лесно може да бъде изрязана с нож като сирене.
Калий и химия
За начало калият е химичен елемент, който има много висока химическа активност. Дори да се съхранява на открито, е невъзможно, тъй като веднага започва да реагира с околните вещества. Калият е химичен елемент, който принадлежи към първата група и четвъртия период на периодичната таблица. Той притежава всички свойства, характерни за металите.
Взаимодействие с прости вещества
Те включват: кислород, азот, сяра, фосфор, халогени (йод, флуор, хлор, бром). За да разгледаме взаимодействието на калий с всеки един от тях. Взаимодействието с кислорода се нарича окисление. По време на тази химична реакция калият и кислородът се консумират в моларно съотношение от четири части към един, което води до образуването на оксида на въпросния метал на две части. Това взаимодействие може да бъде изразено като се използва следното реакционно уравнение: 4K + 02 = 2K2O. Когато изгаряте калий, можете да наблюдавате ярък виолетов пламък.  Следователно, тази реакция се счита за качествена за определяне на калий. Реакциите с халогени се наричат според наименованията на тези химични елементи: йодиране, флуориране, хлориране, бромиране. Тези взаимодействия могат да се нарекат реакции на добавяне, тъй като атомите на две различни вещества се комбинират в едно. Пример за такъв процес е реакцията между калий и хлор, в резултат на което се образува хлоридът на метала. За да се осъществи това взаимодействие, е необходимо да се вземат тези два компонента - две молци от първата и една от втората. В резултат се образуват два мола калиево съединение. Тази реакция се изразява чрез следното уравнение: 2K + CI2 = 2KSI. При азот, калият може да даде съединения при изгаряне на открито. По време на тази реакция въпросният метал и азот се консумират в моларно съотношение от шест части към един, което води до образуването на калиев нитрид на две части. Това може да се покаже под формата на следното уравнение: 6K + N2 = 2K3N. Това съединение е зелено-черен кристал. При фосфора разглежданият метал реагира по същия принцип. Ако вземем три мола калий и един мол фосфор, получаваме един мол фосфид. Това химическо взаимодействие може да бъде написано под формата на такова реакционно уравнение: 3K + P = K3P. В допълнение, калият е в състояние да реагира с водород, образувайки хидрид. Като пример може да се даде това уравнение: 2K + H2 = 2KN. Всички реакции на реакцията се осъществяват само при високи температури.
Следователно, тази реакция се счита за качествена за определяне на калий. Реакциите с халогени се наричат според наименованията на тези химични елементи: йодиране, флуориране, хлориране, бромиране. Тези взаимодействия могат да се нарекат реакции на добавяне, тъй като атомите на две различни вещества се комбинират в едно. Пример за такъв процес е реакцията между калий и хлор, в резултат на което се образува хлоридът на метала. За да се осъществи това взаимодействие, е необходимо да се вземат тези два компонента - две молци от първата и една от втората. В резултат се образуват два мола калиево съединение. Тази реакция се изразява чрез следното уравнение: 2K + CI2 = 2KSI. При азот, калият може да даде съединения при изгаряне на открито. По време на тази реакция въпросният метал и азот се консумират в моларно съотношение от шест части към един, което води до образуването на калиев нитрид на две части. Това може да се покаже под формата на следното уравнение: 6K + N2 = 2K3N. Това съединение е зелено-черен кристал. При фосфора разглежданият метал реагира по същия принцип. Ако вземем три мола калий и един мол фосфор, получаваме един мол фосфид. Това химическо взаимодействие може да бъде написано под формата на такова реакционно уравнение: 3K + P = K3P. В допълнение, калият е в състояние да реагира с водород, образувайки хидрид. Като пример може да се даде това уравнение: 2K + H2 = 2KN. Всички реакции на реакцията се осъществяват само при високи температури.
Взаимодействие със сложни вещества
Характеризирането на калия от гледна точка на химията предвижда разглеждането на тази тема. Комплексните вещества, с които калият реагира, са вода, киселини, соли, оксиди. При всички тези метали реагират по различен начин.
Калий и вода
Този химически елемент реагира с това насилствено. В този случай се образува хидроксид, както и водород. Ако вземем два мола калия и водата, получаваме същата сума калиев хидроксид и един мол водород. Това химическо взаимодействие може да бъде изразено чрез следното уравнение: 2K + 2H2O = 2KOH = H2.
Реакции с киселини
Тъй като калият е активен метал, той лесно измества водородните атоми от техните съединения. Пример за това е реакцията, която възниква между разглежданото вещество и солна киселина. За поведението му трябва да вземете два канала калий, а също и киселината в същото количество. В резултат на това, a калиев хлорид - два мола и водород - един мол. Този процес може да бъде записан със следното уравнение: 2K + 2HCI = 2KSI + H2.
Калий и оксиди
С тази група неорганични вещества разглежданият метал реагира само със значително нагряване. Ако металният атом, който е част от оксида, е пасивен от този, за който говорим в тази статия, всъщност има реакция на обмен. Например, ако вземем два мола калий и един мол кадров оксид, в резултат на тяхното взаимодействие, може да се получи един мол от оксида на въпросния химичен елемент и чист курум. Това може да се покаже под формата на следното уравнение: 2K + CuO = K2O + Cu. Това е мястото, където се появяват силните редуциращи свойства на калий.
Взаимодействие с бази
Калият е в състояние да реагира с металните хидроксиди, които са отдясно на него в серията електрохимична активност. В този случай също се появяват неговите редуциращи свойства. Например, ако вземем два мола калий и един мол бариев хидроксид, в резултат на реакцията на заместване ще получим вещества като калиев хидроксид в количество от два мола и чист барий (един мол) - това ще се утаи. Химичното взаимодействие може да бъде представено като следното уравнение: 2K + Ba (OH) 2 = 2KOH + Ba.
Реакции със соли
В този случай калият все още проявява свойствата си като силен редуциращ агент. Замяната на атоми от химически по-пасивни елементи позволява да се получи чист метал. Например, ако добавим алуминиев хлорид в количество от два мола, три мола калий, а след това в резултат на тази реакция се получават три мола калиев хлорид и два мола алуминий. Експресирайте този процес с помощта на уравнението може да бъде както следва: 3K + 2AІCІ3 = 3KSІ2 + 2АІ.
Реакции с мазнини
Ако калий се добавя към органично вещество от тази група, то също така ще измести един от водородните атоми. Например, когато стеаринът се смесва с въпросния метал, се образува калиев стеарат и водород. Полученото вещество се използва за производството на течен сапун. На това се очертава характеристиката на калий и взаимодействието му с други вещества.
Използването на калий и неговите съединения
Както всички метали, разглеждани в тази статия, са необходими за много процеси в индустрията. Основното приложение на калий се среща в химическата промишленост. Благодарение на високата си химична активност, изразените алкални метали и редуциращите свойства, той се използва като реагент за много взаимодействия и получаване на различни вещества. В допълнение, сплави със съдържание на калий се използват като охлаждащи средства в ядрени реактори. Също така металът, разгледан в тази статия, намира своето приложение в електротехниката. В допълнение към всичко това, той е един от основните компоненти на торовете за растенията. В допълнение, неговите съединения се използват в широк кръг индустрии. Така при извличането на златото се използва калиев цианид, който служи като реагент за възстановяването на ценни метали от руди. При производството на стъкло се прилага калиев карбонат. Фосфатите на въпросния химичен елемент са компоненти на различни почистващи препарати и прахове. В мачовете има хлорат на този метал. При производството на филми за стари фотоапарати се използва бромид на въпросния елемент. Както вече знаете, може да се получи чрез бромиране на калий при висока температура. В медицината се използва хлоридът на този химичен елемент. При производството на сапуни - стеарат и други производни на мазнините.
Подготовка на разглеждания метал

Днес калият се извлича в лабораториите по два основни начина. Първата е да се възстанови от хидроксид с натрий, който е химически още по-активен от калий. И вторият е да го получи от хлорид, също и с помощта на натрий. Ако добавите същото количество натрий към един мол калиев хидроксид, се образува един мол алкален натрий и чист калий. Уравнението за тази реакция е, както следва: KOH + Na = NaOH + К. За втория тип реакция хлоридът на метала и натрий трябва да се смеси в равни моларни пропорции. В резултат на това се образуват вещества като калиева сол и калий в същото съотношение. Това химическо взаимодействие може да бъде изразено чрез следното реакционно уравнение: KSI + Na = NaCl + K.
Структурата на калий
Атомът на този химичен елемент, както всички останали, се състои от ядро, съдържащо протони и неутрони, както и електрони, които се въртят около него. Броят на електроните винаги е равен на броя на протоните, които са вътре в ядрото. Ако някой електрон разединява или свързва атома, той престава да бъде неутрален и се превръща в йон. Те са от два вида: катиони и аниони. Първите имат положителна такса, докато последните имат отрицателна такса. Ако един електрон се присъедини към атома, тогава той се превръща в анион, а ако някой от електроните напусне орбитата си, неутралният атом става катион. Тъй като серийният номер на калий, според таблицата на Менделеев, е деветнадесет, има толкова протони в ядрото на този химически елемент. Затова можем да заключим, че около ядрото има деветнадесет електрона. Броят на протоните, които се съдържат в структурата на атома, може да бъде определен чрез изваждане на атомното число на химичния елемент от атомната маса. Така че можем да заключим, че има двадесет протона в калиевото ядро. Тъй като металът, разглеждан в тази статия, принадлежи към четвъртия период, той има четири орбита, на които електроните са разположени равномерно, които постоянно се движат. Схемата на калий е както следва: в първата орбита има два електрона, на втория - осем, както и на третия, на последната, четвърта орбита, само един електронен се върти. Това обяснява високото ниво на химическа активност на даден метал - последната му орбита не е напълно запълнена, затова се стреми да се свърже с някои други атоми, в резултат на което техните електрони от последните орбити стават често срещани.
Къде можете да намерите този елемент в природата?
Тъй като има изключително висока химическа активност, тя не се среща никъде на планетата в чиста форма. Тя може да се види само в състава на различни съединения. Масова фракция Калият в земната кора е 2,4%. Най-често срещаните минерали, които включват калий, са салвинит и карналлит. Първият има следната химична формула: NaCl • KCl. Има пъстър оцветяване и се състои от много кристали от различни цветове. В зависимост от съотношението на калиевия хлорид към натрий, както и наличието на примеси, той може да съдържа червени, сини, розови, оранжеви компоненти. Вторият минерал, карналил, прилича на прозрачни, меки сини, светло розови или бледожълти кристали. Неговата химична формула изглежда така: KCl • MgCl2 • 6H2O. Това е кристален хидрат.
Ролята на калия в организма, симптомите на липса и излишък
Той, заедно с натрий, поддържа водно-солевия баланс на клетката. Той също така участва в трансфера между мембраните на нервния импулс. В допълнение, той регулира киселино-базовия баланс в клетката и в тялото като цяло. Той участва в процесите на метаболизма, противодейства на появата на оток, е част от цитоплазмата - около петдесет процента от него - солта на метала. Основните признаци, че тялото няма калий, е подпухналост, появата на заболяване като капки, раздразнителност и нарушения в работата на нервната система, забавяне на реакцията и нарушения на паметта.  В допълнение, недостатъчно количество от този микроелемент оказва неблагоприятно въздействие върху сърдечно-съдовите и мускулните системи. Липсата на калий за много дълго време може да предизвика сърдечен удар или инсулт. Но поради излишъка от калий в тялото може да се развие тънка черва. За да балансирате храненето си по такъв начин, че да получите нормално количество калий, трябва да знаете какви продукти съдържа.
В допълнение, недостатъчно количество от този микроелемент оказва неблагоприятно въздействие върху сърдечно-съдовите и мускулните системи. Липсата на калий за много дълго време може да предизвика сърдечен удар или инсулт. Но поради излишъка от калий в тялото може да се развие тънка черва. За да балансирате храненето си по такъв начин, че да получите нормално количество калий, трябва да знаете какви продукти съдържа.
Храна с високо съдържание на въпросния микроелемент
На първо място, това са ядки, като кашу, орехи, лешници, фъстъци, бадеми. Също така, много от тях са в картофите. В допълнение, калий се намира в сушени плодове като стафиди, сушени кайсии, сушени сини сливи. Този елемент е богат на борови ядки. Също така се наблюдава висока концентрация при боб: боб, грах, леща. Морската кале също е богата на този химичен елемент. Други продукти, съдържащи този елемент в големи количества, са зелен чай и какао. Освен това, при висока концентрация се среща в много плодове, като авокадо, банани, праскови, портокали, грейпфрути, ябълки. Много зърнени храни са богати на микронутриентите. Това е преди всичко перлен ечемик, както и пшеница и елда. При магданоз и брюкселско зеле също има много калий. В допълнение, тя се среща в моркови и пъпеши. Лук и чесън имат значително количество от въпросния химичен елемент. Пилешките яйца, млякото и сиренето също са с високо съдържание на калий. Ежедневната норма на този химичен елемент за средния човек е от три до пет грама.
заключение
След като прочетем тази статия, можем да заключим, че калият е изключително важен химически елемент. Необходимо е да се синтезират много съединения в химическата промишленост. В допълнение, тя се използва и в много други индустрии. Също така е много важно за човешкото тяло, следователно трябва редовно и в необходимото количество да отиде там с храна.
 Периодична система на Менделеев. Химични елементи на периодичната таблица
Периодична система на Менделеев. Химични елементи на периодичната таблица Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества
Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества Характеристики на магнезий. Химическият елемент на магнезий
Характеристики на магнезий. Химическият елемент на магнезий Разредена сярна киселина
Разредена сярна киселина Едно вещество в химията е какво? Свойства на веществата. Класове вещества
Едно вещество в химията е какво? Свойства на веществата. Класове вещества Алотропни вещества: диамант и графит. Формула графит и диамант.
Алотропни вещества: диамант и графит. Формула графит и диамант. Хидридите са ... Използването на хидриди
Хидридите са ... Използването на хидриди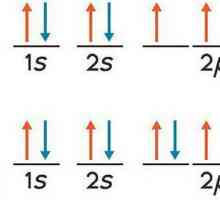 Каква е електронната конфигурация на калий
Каква е електронната конфигурация на калий Сплави на метали
Сплави на метали Качествени реакции
Качествени реакции Неорганична химия. Обща и неорганична химия
Неорганична химия. Обща и неорганична химия Физически вещества: примери и описание
Физически вещества: примери и описание Алкални метали
Алкални метали Алкални земни метали: кратко описание
Алкални земни метали: кратко описание Физични и химични свойства на металите
Физични и химични свойства на металите Термична проводимост на металите и тяхното приложение
Термична проводимост на металите и тяхното приложение Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията
Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията Химията е вълнуваща!
Химията е вълнуваща! Основни сектори на химията: описание, характеристики и интересни факти
Основни сектори на химията: описание, характеристики и интересни факти Точка на топене на металите
Точка на топене на металите Метални свойства на химическите елементи
Метални свойства на химическите елементи


