Сулфатна киселина: формула и химични свойства
Една от първите минерални киселини, станала известна на човека, е сярна или сулфатна. Не само самата тя, но и многото й соли са използвани в строителството, медицината, хранителната промишленост за технически цели. Досега нищо не се е променило в това отношение. Редица характеристики, които притежава сулфатната киселина, го правят просто незаменими в химическите синтези. В допълнение, практически всички отрасли на ежедневието и индустрията намират използването на солта си. Поради това в детайли ще разгледаме какво представлява и какви са характеристиките на проявените свойства.
съдържание

Разнообразие от имена
За начало има много имена за това вещество. Сред тях са онези, които са оформени според рационалната номенклатура и тези, които са се развили исторически. Така че тази връзка е означена като:
- сулфатна киселина;
- стъкловидно масло;
- сярна киселина;
- олеум.
Въпреки че терминът "олеум" не е напълно подходящ за това вещество, тъй като е смес от сярна киселина и висок оксид сяра - SO3.
Сулфатна киселина: формулата и структурата на молекулата
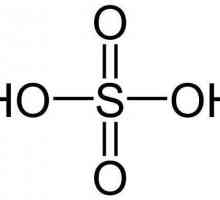
От гледна точка на химически съкращения напиши формула на тази киселина може да бъде така: Н2SO4. Очевидно е, че молекулата се състои от два водородни катиона и един анион на киселинния остатък - сулфатен йон, имащ заряд от 2+.
Същевременно в молекулата действат следните връзки:
- ковалентно полярно между сяра и кислород;
- ковалентно силно полярен между водород и киселинен остатък SO4.
Сярата, притежаваща 6 непанални електрони, образува две двойни връзки с два кислородни атома. Все още с двойка - единична, а тези, на свой ред - единични с водород. В резултат структурата на молекулата позволява тя да бъде достатъчно силна. В същото време, водородният катион е много подвижен и лесно се оставя, защото сярата и кислородът са много по-електрични. Чрез издърпване на електронната плътност върху себе си, те осигуряват частично положително зареждане на водорода, което става пълно при изключване. По този начин се образуват кисели разтвори, при които Н+.
Ако говорим за степента на окисляване на елементите в съединението, тогава сулфатната киселина, чиято формула Н2SO4, лесно прави възможно изчисляването им: за водород +1, за кислород -2, за сяра +6.
Както във всяка молекула, общото зареждане е нула.

История на откритието
Сулфатната киселина е известна на хората от древни времена. Дори алхимиците знаеха как да го получат чрез методи за калциниране на различни витрили. От IX век хората са получили и са използвали това вещество. По-късно в Европа Алберт Магнус се научи да извлича киселина в процеса на разлагане на железен сулфат.
Въпреки това, нито един от методите не беше печеливш. Тогава стана известна така наречената камерна версия на синтеза. За тази сяра и нитрат, и еволюирали изпарения абсорбира вода. В резултат се образува сулфатна киселина.
Дори по-късно британците успяват да намерят най-евтиния метод за получаване на това вещество. За това, пирит-FeS2, железни пирити. Неговото изгаряне и последващото взаимодействие с кислорода все още представляват един от най-важните промишлени методи за синтез на сярна киселина. Тези суровини са по-достъпни, по-евтини и с високо качество за големи обеми производство.

Физични свойства
Има няколко параметъра, включително външни, в които сулфатната киселина се различава от другите. Физическите му свойства могат да бъдат описани в няколко точки:
- При стандартни условия, течност.
- В концентрирано състояние е тежък, мазен, за който се нарича "стъкловидно масло".
- Плътността на веществото е 1,84 g / cm3.
- Няма цвят и мирис.
- Има изразен "меден" вкус.
- Разтваря се във водата много добре, почти неограничено.
- Хигроскопичен, способен да улови както свободната така и свързаната вода от тъканите.
- Енергонезависимото.
- Точката на кипене е 296заS.
- Температура на топене 10.3заS.
Една от най-важните характеристики на това съединение е способността му да се хидратира с освобождаването на голямо количество топлина. Ето защо дори от училище децата се учат, че по никакъв начин не е възможно да се добави вода към киселина, а само обратното. В края на краищата, плътността на водата е по-лесно, така че тя ще се натрупва на повърхността. Ако я добавите рязко към киселината, тогава в резултат на реакцията на разтваряне ще се освободи толкова много енергия, че водата ще се вари и ще започне да се пръска заедно с частиците на опасното вещество. Това може да причини тежки химически изгаряния на кожата на ръцете.
Ето защо е необходимо да се излее киселината във водата с тънка струя, след което сместа ще се загрее силно, но няма да има ефервесценция, което означава, че течността се напръсква също.

Химични свойства
От гледна точка на химията тази киселина е много силна, особено ако тя е концентрирано решение. Той е двуосновен, така че той се отделя постепенно, образувайки водороден сулфат и сулфатен анион.
Като цяло, взаимодействието му с различни съединения отговаря на всички основни реакции, характерни за този клас вещества. Може да се дадат примери за няколко уравнения, в които участва сулфатната киселина. Химичните свойства се проявяват в неговото взаимодействие с:
- соли;
- оксиди и хидроксиди на метали;
- амфотерни оксиди и хидроксиди;
- метали, стоящи в серия напрежения до водорода.
В резултат на такива взаимодействия, в почти всички случаи се образуват средните соли на тази киселина (сулфати) или киселини (хидросулфати).
Специална особеност е и с металите в обичайната схема Me + H2SO4 = MeSO4 + Н2реагира само с разтвор на това вещество, т.е. с разредена киселина. Ако вземете концентрирана или силно наситена (олеум), тогава продуктите за взаимодействие ще бъдат напълно различни.

Специални свойства на сярна киселина
Това е взаимодействието на концентрирани разтвори с метали. Така че има определена схема, която отразява целия принцип на такива реакции:
- Ако металът е активен, резултатът е образуването на сероводород, сол и вода. Тоест сярата се възстановява на -2.
- Ако металът е със средна активност, резултатът е сяра, сол и вода. Това означава намаляване на сулфатния йон до свободна сяра.
- Метали с ниска химична активност (след водород) - серен диоксид, сол и вода. Сяра в окислително състояние +4.
Също така, специалните свойства на сулфатната киселина са способността да окисляват някои неметали до тяхното най-високо окислително състояние и да реагират с комплексните съединения и да ги окисляват до прости вещества.
Методи на производство в промишлеността
Процесът на производство на сярна киселина се състои от два основни типа:
- ПИН;
- кула.
И двата са най-разпространените методи в индустрията във всички страни по света. Първият вариант се основава на използването на железни пирити или серен пирит като изходна суровина - FeS2. Има общо три етапа:
- Изгаряне на суровини с образуване на серен диоксид като изгарящ продукт.
- Предаване на този газ през кислород през ванадиев катализатор за образуване на сярен анхидрид-SO3.
- В абсорбционната кула анхидридът се разтваря в разтвор на сулфатна киселина с образуването на разтвор с висока концентрация - олеум. Много тежка мазна дебела течност.
Вторият вариант е практически еднакъв, но азотните оксиди се използват като катализатор. От гледна точка на такива параметри като качество на продукта, разход и консумация на енергия, чистота на суровините, производителност, първият метод е по-ефикасен и приемлив, поради което е по-често използван.

Синтез в лабораторията
Ако е необходимо да се получи сярна киселина в малки количества за лабораторни изследвания, тогава най-добрият начин е начинът на взаимодействие на сероводород с нискодействащи метални сулфати.
В тези случаи се образуват черни метални сулфиди и се образува сярна киселина като страничен продукт. За малки проучвания, тази опция е подходяща, но чистотата на такава киселина няма да се различава.
Също така в лабораторията е възможно да се проведе качествена реакция към сулфатни разтвори. Най-често срещаният реагент е бариев хлорид, тъй като Ба йонът2+ заедно със сулфатния анион се утаява в бяла утайка - баритово мляко: Н2SO4 + БАКЛ2 = 2HCL + BaS024↓
Най-често срещаните соли
Сулфатната киселина и сулфатите, които се образуват, са важни съединения в много отрасли и домакинства, включително храна. Най-често срещаните соли на сярна киселина са следните:
- Гипс (алабастър, селенит). Химичното наименование е воден калциев хидрат на калциев сулфат. Формула: CaSO4. Използва се в строителството, медицината, производството на целулоза и хартия и производството на бижута.
- Барит (тежък щит). Сулфат от барий. В разтвора се съдържа млечна утайка. В твърда форма - прозрачни кристали. Използва се в оптични инструменти, рентгенови лъчи, за производство на изолационно покритие.
- Mirabilit (сол на Glauber). Химичното наименование е кристален хидрат натриев сулфат декахидратната. Формула: Na2SO410H2О. Той се използва в медицината като слабително.
Възможно е да се дадат като пример много соли, които са от практическо значение. Обаче, споменатите по-горе са най-често срещаните.

Сулфатна луга
Това вещество е решение, което се формира поради термичната обработка на дървесината, т.е. целулозата. Основната цел на това съединение е получаването на сулфатен сапун на основата му чрез утаяване. Химическият състав на сулфатната течност е, както следва:
- лигнин;
- хидрокси киселини;
- монозахариди;
- феноли;
- смоли;
- летливи и мастни киселини;
- сулфиди, хлориди, карбонати и натриеви сулфати.
Съществуват два основни типа на това вещество: бели и черни сулфатни течности. Бели листа за производство на целулоза и хартия, а черно се използва за производството на сулфатен сапун в промишлеността.
Основни приложения
Годишното производство на сярна киселина е 160 милиона тона годишно. Това е много значима цифра, която показва важността и разпространението на това съединение. Има няколко индустрии и места, където е необходимо да се използва сулфатна киселина:
- В батериите, като електролит, особено в олово.
- В заводите, където се произвеждат сулфатни торове. По-голямата част от тази киселина отива точно до производството на минерално торене за растенията. Поради това растенията за производство на сярна киселина и производството на торове са най-често изградени един до друг.
- В хранителната промишленост като емулгатор, означен с код Е513.
- В множество органични синтези като средство за отстраняване на вода, катализатор. Така че експлозиви смоли, почистващи и миещи средства, найлон, полипропилен и етилен, бои, химически влакна, естери и други съединения.
- Използва се в филтри за пречистване на вода и производство на дестилирана вода.
- Прилага се при добива и преработката на редки елементи от рудата.
Също така, много сярна киселина отива в лабораторните изследвания, където се получава чрез местни методи.
 Къде да закупите сярна киселина? Места за продажба и съвети
Къде да закупите сярна киселина? Места за продажба и съвети Сярна киселина и нейната употреба
Сярна киселина и нейната употреба Производство на сярна киселина. Методи за приготвяне. приложение
Производство на сярна киселина. Методи за приготвяне. приложение Сярна киселина. Формула, свойства, производство и приложение
Сярна киселина. Формула, свойства, производство и приложение Разредена сярна киселина
Разредена сярна киселина Концентрирана сярна киселина в промишленото производство
Концентрирана сярна киселина в промишленото производство Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали
Взаимодействие на киселини с метали. Взаимодействие на сярна киселина с метали Формулата на борна киселина в химията
Формулата на борна киселина в химията Сяров оксид
Сяров оксид Естери: общи характеристики и приложение
Естери: общи характеристики и приложение Киселинни оксиди: кратко описание на групата
Киселинни оксиди: кратко описание на групата Кисел газ. Формула, производство, химични свойства
Кисел газ. Формула, производство, химични свойства Сярна киселина. Химични свойства, производство
Сярна киселина. Химични свойства, производство Хидробромна киселина. Методи за приготвяне, физични и химични свойства
Хидробромна киселина. Методи за приготвяне, физични и химични свойства Сулфаминова киселина. Физични и химични свойства. приложение
Сулфаминова киселина. Физични и химични свойства. приложение Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа
Хлорна киселина - свойства, производство, приложение. Предпазни мерки за работа Химични свойства на киселините
Химични свойства на киселините Азотна киселина. Химични и физични свойства
Азотна киселина. Химични и физични свойства Азотна киселина: химична формула, свойства, производство и приложение
Азотна киселина: химична формула, свойства, производство и приложение Фосфорна киселина, нейните физикохимични свойства и приложение
Фосфорна киселина, нейните физикохимични свойства и приложение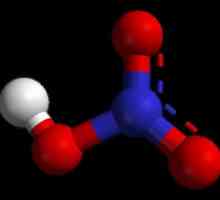 Каква е най-силната киселина?
Каква е най-силната киселина?