Амините са ... Структура, свойства, класове амини
Амините влязоха в живота ни напълно неочаквано. Доскоро това бяха отровни вещества, чийто сблъсък можеше да доведе до смърт. И сега, след век и половина, ние активно използваме синтетични влакна, тъкани, строителни материали, багрила на базата на амини. Не, те не станаха по-безопасни, просто хората можеха да ги "опитоми" и да ги подчинят, спечелвайки някаква полза за себе си. За кой, и ние ще говорим по-нататък.
съдържание
дефиниция

Ами са органични съединения, които са производни на амоняк, в молекулите на които водородът е заменен с въглеводородни радикали. Те могат да бъдат до четири наведнъж. Конфигурацията на молекулите и броят на радикалите определят физичните и химичните свойства на амините. В допълнение към въглеводородите, такива съединения могат да съдържат ароматни или алифатни радикали или комбинация от тях. Отличителен признак на този клас е присъствието на R-N-фрагмент, в който R е органична група.
класификация

Всички амини могат да бъдат разделени на три големи групи:
- По природа на въглеводородния радикал.
- Броят на радикалите, свързани към азотен атом.
- Чрез броя на амино групите (моно-, ди-, три- и т.н.).
Първата група включва алифатни или ограничаващи амини, от които представители са метиламин и метилетиламин. А също и ароматни - например анилин или фениламин. Имената на представителите на втората група са пряко свързани с броя на въглеводородните радикали. Така се изолират първични амини (съдържащи една азотна група), вторични (имащи две групи азот в комбинация с различни органични групи) и третични (съответно с три азотни групи). Имената на третичната група говорят сами за себе си.
Номенклатура (наименование)

За да се образуват името на съединение с името на органична група, която се свързва с азот, добавя префикс "амин" и групите се са споменати по азбучен ред, например: metilprotilamin или methyldiphenylamine (в този случай, "ди" показва, че съединението има два радикала фенил). Възможно е да се оформи наименование на базата на въглерод, а амино групата е представена като заместител. Тогава неговата позиция се определя от индекса под наименованието на елемента, например, СН3СН2CH (NH2) CH2СН3. Понякога в горния десен ъгъл цифрата показва въглеродния последователен номер.
Някои съединения все още запазват тривиални, добре известни опростени наименования, като анилин, например. В допълнение, някои от тях може да се срещне такава, че те са неправилно изтеглени имената, които се използват на равна нога с систематичен, защото учените и хората далеч от науката, е по-лесно и по-удобно да общуват и да се разбират помежду си
Физични свойства

Вторичният амин, подобно на първичния амин, може да се образува водородни връзки между молекулите, въпреки че е малко по-слаб от обичайното. Този факт обяснява по-високата точка на кипене (над сто градуса), присъща на амини, в сравнение с други съединения с подобно молекулно тегло. Третият амин, поради отсъствието на N-H групата, не е способен да образува водородни връзки, така че започва да кипи още при осемдесет и девет градуса по Целзий.
При стайна температура (18-20 градуса по Целзий) само нисши алифатни амини са под формата на пара. Средните са в течно състояние, докато по-високите са в твърдо състояние. Всички класове амини имат специфична миризма. Долните органични радикали в молекулата, така че е по-ясно от практически без мирис високи миришещи съединения за риболов средната и долната вонящи амоняк.
Амините могат да образуват силни водородни връзки с вода, т.е. те са силно разтворими в тях. Колкото повече въглеводородни радикали присъстват в молекулата, толкова по-слабо разтворим е.
Химични свойства

Тъй като е логично да се приеме, амини са производни на амоняк и поради това имат подобни свойства. Обикновено можем да различим три вида химични взаимодействия, които са възможни за тези съединения.
- Първо, ние разглеждаме свойствата на амини като основи. Долната (алифатна), свързваща се с водните молекули, дава алкална реакция. Връзката се формира от донор-акцепторния механизъм, поради факта, че азотният атом има непълен електронен. Когато взаимодействат с киселини, всички амини образуват соли. Това са твърди, силно разтворими във вода вещества. Ароматните амини проявяват по-слаби базови свойства, тъй като тяхната неразделяема електронна двойка е изместена към бензеновия пръстен и взаимодейства с неговите електрони.
- Окисление. Третият амин лесно се окислява чрез комбиниране с кислород в околния въздух. В допълнение, всички амини са способни да се възпламенят от открит пламък (за разлика от амоняка).
- Взаимодействие с азотна киселина се използва в химията, за да се разграничат амините помежду си, тъй като продуктите от тази реакция зависят от количеството органични групи, присъстващи в молекулата:
- ниските първични амини образуват алкохоли в резултат на реакцията;
- ароматни първични при подобни условия дават феноли;
- вторични се превръщат в нитрозо съединения (както се вижда от характерната миризма);
- третичните соли образуват соли, които бързо се разпадат, така че стойността на такава реакция не е такава.
Специални свойства на анилина

Анилин е съединение, което притежава свойствата присъщи както на амино групата, така и на бензоловата група. Това се обяснява с взаимното влияние на атомите вътре в молекулата. От една страна, бензеновият пръстен отслабва основните (т.е. алкални) проявления в анилиновата молекула. Те са по-ниски от тези на алифатните амини и амоняка. Но от друга страна, когато аминогрупата влияе на бензеновия пръстен, тя става, напротив, по-активна и влиза в заместваща реакция.
За качествено и количествено определяне на анилина в разтвори или съединения, реакция с бромна вода, в края на което се появява бяла утайка под формата на 2,4,6-трибромоанилин в дъното на тръбата.
Амини в природата
Амините се срещат в природата навсякъде под формата на витамини, хормони, междинни продукти на метаболизма, те са в тялото на животните и растенията. В допълнение, когато се разлагат живи организми, се произвеждат и средни амини, които в течно състояние разпространяват неприятната миризма на саламура. Широко описано в литературата "катарамична отрова" се появява точно поради специфичните амбра амини.
От дълго време веществата, които изследвахме, бяха объркани с амоняка поради подобна миризма. Но в средата на деветнадесети век френският химик Урз успява да синтезира метиламин и етиламин и да докаже, че когато изгарят, те отделят въглеводород. Това е основна разлика между споменатите съединения и амоняка.
Производство на амини в промишлени условия
Тъй като азотният атом в амини е в най-ниското състояние на окисляване, редукцията на съдържащите азот съединения е най-простият и най-достъпен начин за тяхното получаване. Той се използва широко в индустриалната практика поради своята евтиност.
Първият метод е редукцията на нитросъединенията. Реакцията, по време на която се образува анилин, се нарича учен Зийн и се провежда за пръв път в средата на XIX век. Вторият метод се състои в редукция на амидите с литиево-алуминиев хидрид. От нитрилите също е възможно да се възстановят първичните амини. Третият вариант е реакциите на алкилиране, т.е. въвеждането на алкилови групи в амонячните молекули.
Използването на амини

В себе си, под формата на чисти вещества, амини се използват малко. Един от редките примери е полиетилен полиамин (PEPA), който при домашни условия улеснява втвърдяването на епоксидна смола. Като цяло първичният, третичният или вторичният амин е междинен продукт при производството на различни органични вещества. Най-популярен е анилин. Това е основата на голяма палитра от анилинови багрила. Цветът, който ще се получи в края, зависи пряко от избраната суровина. Чистият анилин дава син цвят, а смес от анилин, орто- и пара-толуидин ще бъде червена.
Алифатни амини са необходими за производството на полиамиди, като например найлон и други синтетични влакна. Те се използват в машиностроенето, както и в производството на въжета, тъкани и филми. В допълнение, алифатни диизоцианати се използват при производството на полиуретани. Благодарение на своите изключителни свойства (лекота, сила, гъвкавост и способност да се придържат към всички повърхности), те са необходими в строителството (пяна, лепило) и в обувната промишленост (приплъзване единствен).
Медицината е друга област, в която се използват амини. Химията помага да се синтезират антибиотици от група сулфонамиди, които успешно се използват като лекарства от втора линия, т.е. резервни копия. В случай че бактериите развият резистентност към основни лекарства.
Вреден ефект върху човешкото тяло
Известно е, че амини са много токсични вещества. Увреждането на здравето може да причини каквото и да е взаимодействие с тях: вдишване на пари, контакт с откритата кожа или вкарване на съединения в тялото. Смъртта настъпва от липса на кислород, така че амини (особено анилин) се свързва с хемоглобина в кръвта и не го да улови молекули на кислород. Тревожни симптоми са недостиг на въздух, синьо назолабиални триъгълник и пръстите, тахипнея (учестено дишане), тахикардия, загуба на съзнание.
Ако тези вещества попаднат в голи части на тялото, те трябва бързо да се отстранят с памучна вата, предварително навлажнена с алкохол. Правете това възможно най-внимателно, за да не увеличавате площта на замърсяването. Ако се появят симптоми на отравяне, винаги трябва да се свържете с Вашия лекар.
Алифатните амини са отрова за нервната и сърдечно-съдовата система. Те могат да причинят депресия на черния дроб, неговата дистрофия и дори рак на пикочния мехур.
 Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества
Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества Класификация на органичните вещества - основата за изучаване на органичната химия
Класификация на органичните вещества - основата за изучаване на органичната химия Физични свойства на алдехидите
Физични свойства на алдехидите Органичните вещества имат своите характеристики и класификация
Органичните вещества имат своите характеристики и класификация Въглеводородите са ... Крайните въглеводороди. Класове на въглеводородите
Въглеводородите са ... Крайните въглеводороди. Класове на въглеводородите Циклични наситени въглеводороди: как се произвеждат. циклоалкани
Циклични наситени въглеводороди: как се произвеждат. циклоалкани Аминокиселини: биохимия, класификация
Аминокиселини: биохимия, класификация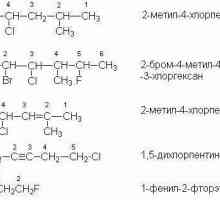 Какво представлява систематичната номенклатура
Какво представлява систематичната номенклатура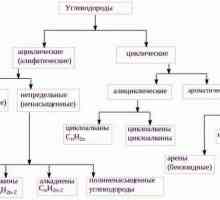 Алифатни въглеводороди са какво?
Алифатни въглеводороди са какво? Структурата на аминокиселините. Определяне и класификация на аминокиселини
Структурата на аминокиселините. Определяне и класификация на аминокиселини Химия: общата формула на мазнините
Химия: общата формула на мазнините Органични съединения и тяхната класификация
Органични съединения и тяхната класификация Химични свойства на алкани
Химични свойства на алкани Химични свойства на алкохоли
Химични свойства на алкохоли Гранични въглеводороди: общи характеристики, изомеризъм, химични свойства
Гранични въглеводороди: общи характеристики, изомеризъм, химични свойства Серията хомология
Серията хомология Етери. особеност
Етери. особеност Най-големите клетки от органична материя
Най-големите клетки от органична материя Радикалът в химията е какво? Теория на радикалите в химията
Радикалът в химията е какво? Теория на радикалите в химията Каква е рационалната номенклатура
Каква е рационалната номенклатура Естери: химични свойства и приложения
Естери: химични свойства и приложения