Реакции на заместване: описание, уравнение, примери
Много реакции на заместване отварят пътя към получаването на различни съединения, които имат икономическо приложение. Огромна роля в химическата наука и промишлеността има електрофилното и нуклеофилното заместване. В органичния синтез тези процеси имат редица характеристики, които трябва да се отбележат.
съдържание
- Разнообразие от химически феномени. Реакции на заместване
- Заместващ хомолитичен (радикал, sr)
- Хетеролитен метод за прекъсване на комуникацията
- Електрофили и нуклеофили
- Заместването нуклеофилно (sn)
- Електрофилно заместване (se)
- Мономолекулни и бимолекулни реакции
- Механизмът на хетеролитичното заместване
- Реакции на заместване на бензен
- Примери на заместващи реакции от органичната химия
Разнообразие от химически феномени. Реакции на заместване
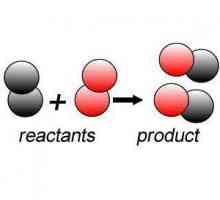
Химическите промени, свързани с преобразуването на веществата, имат редица характеристики. Различни могат да бъдат окончателни резултати, топлинни ефекти, някои процеси отиват до края, други се появяват химическо равновесие. Промяната на веществата често се съпровожда от увеличаване или намаляване на степента на окисление. При класифицирането на химичните феномени с крайния им резултат се обръща внимание на качествените и количествените разлики между реагентите и продуктите. Тези функции могат да бъдат разграничени 7 видове химични реакции, включително заместване протича съгласно схемата: А-В-С A + C + Б. опростена запис на цял клас химически явления дава представа, че между изходните материали е така наречената "атакуващия "Част, която замества атома, йонната и функционалната група в реагента. Реакцията на заместването е характерна за ограничаване и ароматни въглеводороди.

Заместващите реакции могат да се появят като двоен обмен: A-B + C-E A-C + B-E. Един от подвидовете е изместването, например, на мед с желязо от разтвор на меден сулфат: CuSO4 + Fe = FeSO4 + Cu. Като "атакуващи" частици могат да действат като атоми, йони или функционални групи

Заместващ хомолитичен (радикал, SR)
Под радикалния механизъм на разкъсване на ковалентните връзки електронната двойка, която е обща за различните елементи, се разпределя пропорционално между "фрагментите" на молекулата. Създават се свободни радикали. Това са нестабилни частици, чието стабилизиране се случва в резултат на последващи трансформации. Например, когато се получава етан от метан, се появяват свободни радикали, които участват в реакцията на заместване: CH4 СН3• + • Н- СН3• + • CH3 → С2Н5-Н + + Н + Н2. Хомолитично разрушаване на връзката съгласно горния заместващ механизъм е типично за алканите, реакцията има верижен знак. В метана, атомите на Н могат да бъдат последователно заменени с хлор. Подобно, реакцията с бром, но йодът не е в състояние директно да замести водорода в алкани, флуорът реагира твърде енергично на тях.

Хетеролитен метод за прекъсване на комуникацията
Под йонния механизъм на протичането на реакциите на заместване, електроните се разпределят неравномерно между новообразуваните частици. Свързващата двойка електрони се придвижва напълно до един от "фрагментите", най-често до този комуникационен партньор, към който се измества отрицателната плътност в полярната молекула. Заместващите реакции включват образуване на метилов алкохол СН3ОН. В бромметан CH3Br разрушаването на молекулата е хетеролитно, заредените частици са стабилни. Метил придобива положителен заряд, а бромът - отрицателен: CH3Br → CH3+ + Br-- NaOH → Na+ + OH-- СН3+ + OH- → CH3ОН- Na+ + Br- harr- NaBr.

Електрофили и нуклеофили
Частиците, които нямат електрони и могат да ги приемат, се наричат "електрофили". Те включват въглеродни атоми, свързани с халогени в халоалкани. Нуклеофилите имат повишена електронна плътност, "жертват" двойка електрони, когато създават ковалентна връзка. При реакциите на заместване нуклеофилите, богати на отрицателни заряди, се атакуват от електрофили, които изпитват недостиг на електрони. Това явление е свързано с изместването на атом или друга частица - изходящата група. Друг тип реакция на заместване е електрофилната атака от нуклеофила. Понякога е трудно да се разграничи между два процеса, да се посочи замяната с един или друг тип, тъй като е трудно да се определи точно коя от молекулите е субстрат и която е реагент. Обикновено в такива случаи се вземат предвид следните фактори:
- естеството на изходящата група;
- реактивността на нуклеофила;
- естеството на разтворителя;
- структурата на алкиловата част.
Заместването нуклеофилно (SN)
В процеса на взаимодействие се наблюдава увеличаване на поляризацията в органичната молекула. В уравненията частичната положителна или отрицателна такса се отбелязва с буквата на гръцката азбука. Поляризацията на връзката дава възможност да се прецени естеството на нейното прекъсване и последващото поведение на "фрагментите" на молекулата. Например, въглеродният атом в йодометан има частично положителен заряд, е електрофилен център. Тя привлича тази част от водния дипол, където се намира кислород, който има излишък от електрони. Когато електрофилът взаимодейства с нуклеофилния реагент, се образува метанол: СН3I + Н2O → CH3OH + HI. Реакции на нуклеофилно заместване се провеждат с участието на отрицателно зареден йон или молекула, притежаваща двойка свободни електрони, която не участва в създаването на химическа връзка. Активно участие на йодометан в SN2-реакциите се обясняват с откритостта му към нуклеофилната атака и мобилността на йода.

Електрофилно заместване (SE)
Органичната молекула може да има нуклеофилен център, за който е характерен излишък от електронна плътност. Той реагира с липса на отрицателни заряди с електрофилен реагент. Такива частици включват атоми, които имат свободни орбитали, молекули със сайтове с намалена електронна плътност. В натриев формиат въглеродът има заряд ";" взаимодейства с положителната част на водния дипол - с водород: CH3Na + H2O → CH4 + NaOH. Продуктът от тази електрофилна реакция на заместване е метан. При хетеролитичните реакции взаимодействат обратно заредените центрове на органичните молекули, което им придава подобие на йоните в химията на неорганичните вещества. Не трябва да се пренебрегва, че превръщането на органичните съединения рядко се съпровожда от образуването на истински катиони и аниони.

Мономолекулни и бимолекулни реакции
Нуклеофилното заместване е мономолекулярно (SN1). Чрез този механизъм протича хидролиза на важен продукт от органичния синтез - третичен бутил хлорид. Първият етап е бавен, той се асоциира с постепенна дисоциация на карониевия катион и хлоридния анион. Вторият етап протича по-бързо, реакцията на карбониевия йон с вода протича. Уравнението на реакцията заместване на халоген в алкана за хидроксилната група и получаване на първичен алкохол: (CH3)3С-С1- (СН3)3C+ + Cl-- (СН3)3C+ + Н2O → (CH3)3С-ОН + Н+. Едноетапната хидролиза на първични и вторични алкилхалиди се характеризира с едновременното разрушаване на въглерод-халогенната връзка и образуването на С-ОН двойка. Това е механизмът на нуклеофилно бимолекулно заместване (SN2).
Механизмът на хетеролитичното заместване
Механизмът на заместване е свързан с електронен трансфер, създаването на междинни комплекси. Реакцията протича по-бързо, по-леките междинни продукти, които са характерни за него. Често процесът се извършва едновременно в няколко посоки. Предимството обикновено получава начина, по който се използват частиците, които изискват най-малко енергийни разходи за тяхното образование. Например, наличието на двойна връзка увеличава вероятността от появата на алилов катион СН2 = СН-СН2+, в сравнение с йон СН3+. Причината е в електронната плътност на множествената връзка, която засяга делокализирането на положителния заряд, разпределен в молекулата.
Реакции на заместване на бензен
Групата органични съединения, които се характеризират с електрофилно заместване, - арени. Бензеновият пръстен е удобен обект за електрофилни атаки. Процесът започва с поляризацията на връзката във втория реагент, което води до образуването на електрофил, съседен на електронния облак на бензеновия пръстен. В резултат на това се появява преходен комплекс. Пълната връзка на електрофилните частици с един от въглеродните атоми все още не е достъпна, тя е привлечена от целия отрицателен заряд на "ароматните шест" електрона. В третия етап на процеса, електрофилът и един въглероден пръстен атом са свързани с обща електронна двойка (ковалентна връзка). Но в този случай "ароматните шест" са унищожени, което е нерентабилно от гледна точка на постигане на стабилно стабилно енергийно състояние. Има явление, което може да се нарече "протонно излъчване". Има разделяне на H+, стабилната комуникационна система, характерна за арена, се възстановява. Страничният продукт съдържа водороден катион от бензеновия пръстен и анион от втория реактив.

Примери на заместващи реакции от органичната химия
За алканите реакцията на заместване е особено характерна. Примери за електрофилни и нуклеофилни трансформации могат да бъдат цитирани за циклоалкани и арени. Подобни реакции в молекулите на органичните вещества се случват при нормални условия, но по-често - при нагряване и в присъствието на катализатори. Широко разпространените и добре проучени процеси включват електрофилно заместване в ароматното ядро. Най-важните реакции от този тип са:
- Нитриране на бензен азотна киселина в присъствието на Н2SO4 - върви по схемата:6Н6 → C6Н5-NO2.
- Каталитично халогениране на бензен, по - специално хлориране, по уравнението:6Н6 + Cl2 → C6Н5Cl + HCI.
- Ароматната сулфонация на бензен протича с "димяща" сярна киселина, като се образуват бензенсулфонови киселини.
- Алкилирането е замяната на водородния атом от бензеновия пръстен с алкил.
- Ацилирането е образуването на кетони.
- Образуване - замяната на водород от групата СНО и образуването на алдехиди.
Заместващите реакции включват реакция в алкани и циклоалкани, при които халогени атакуват наличната С-Н връзка. Дериватизацията може да бъде свързана със заместването на един, два или всички водородни атоми в наситени въглеводороди и циклопарафини. Много от халогеноалканите с малка молекулна маса намират приложение при производството на по-сложни вещества, принадлежащи към различни класове. Успехите, постигнати при изучаването на механизмите на реакциите на заместване, дадоха мощен импулс за развитието на синтези, базирани на алкани, циклопарафини, арени и халогенирани въглеводороди.
 Реакция на съединението: Примери и формула
Реакция на съединението: Примери и формула Каква е реакцията на разлагане в химията? Примери на реакцията на разлагане
Каква е реакцията на разлагане в химията? Примери на реакцията на разлагане Реакцията на съединението. Примери за реакция на съединение
Реакцията на съединението. Примери за реакция на съединение Качествени реакции към фенола. Приготвяне на феноли: реакции
Качествени реакции към фенола. Приготвяне на феноли: реакции Хомогенни реакции.
Хомогенни реакции. Какъв е химическият процес? Химическият процес: същността и ролята в природата
Какъв е химическият процес? Химическият процес: същността и ролята в природата Химически уравнения: как да се реши най-ефективно
Химически уравнения: как да се реши най-ефективно Химични реакции: защо алхимиците са погрешни
Химични реакции: защо алхимиците са погрешни Видове химични реакции
Видове химични реакции Химични свойства на алкани
Химични свойства на алкани Класове неорганични съединения
Класове неорганични съединения Какъв е метаболизмът и неговата роля в човешкото тяло
Какъв е метаболизмът и неговата роля в човешкото тяло Бензоена киселина
Бензоена киселина Класификация на химическите реакции
Класификация на химическите реакции Химически феномени в ежедневието
Химически феномени в ежедневието Фактори, влияещи върху скоростта на химическата реакция
Фактори, влияещи върху скоростта на химическата реакция Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията
Реакциите, настъпващи в нехомогенна среда, се наричат ... Типове реакции в химията Каква е каталитичната реакция? Основни принципи и видове
Каква е каталитичната реакция? Основни принципи и видове Пропанът е екологично гориво. Неговите физични и химични свойства
Пропанът е екологично гориво. Неговите физични и химични свойства Производство на алкани и техните свойства
Производство на алкани и техните свойства Химичното равновесие е основата на обратимите химични реакции
Химичното равновесие е основата на обратимите химични реакции