Основни хидроксиди и техните химични свойства
Основните класове неорганични вещества, с изключение на оксиди, киселини и соли, включват група съединения, наречени бази или хидроксиди. Всички те имат единствен план за структурата на молекулата: те задължително съдържат една или повече хидроксилни групи, свързани с металния йон. Основните хидроксиди са генетично свързани с металните оксиди и соли, което води не само до техните химични свойства, но и до производствени методи в лабораторията и промишлеността.
съдържание
- Физични свойства
- Структурата на базовата молекула
- Калций и магнезий и свойствата на техните съединения
- Области на приложение на калциеви и магнезиеви съединения
- Свойства на основни оксиди и хидроксиди
- Възможност за електролизиране
- Приготвяне на основи
- Взаимодействие на алкали с киселинни и амфотерни оксиди
- Реакция на неутрализация

Има няколко форми на класификация на базите, които се основават както на характеристиките на метала, който е част от молекулата, така и на способността на веществото да се разтваря във вода. В тази статия ще разгледаме тези характеристики на хидроксидите и също така ще се запознаем с техните химични свойства, от които зависи използването на бази в промишлеността и ежедневието.
Физични свойства
Всички бази, образувани от активни или типични метали, са твърди вещества, имащи широк диапазон от точки на топене. По отношение на водата те се разделят на силно разтворими - алкални и неразтворими във вода. Например, основни хидроксиди, съдържащи елементи от група IA като катиони лесно се разтварят във вода и са силни електролити. Те са сапун на пипане, корозират тъканта, кожата и се наричат алкали. Когато се дисоциират в разтвор, се откриват йони на ОН-, определени чрез индикатори. Например, безцветен фенолфталеин в алкална среда става пурпурен. И двата разтвора и стопилки на натриев, калиев, бариев, калциев хидроксид са електролити, т.е. провеждат електрически ток и се считат за проводници от втория вид. Към разтворимите бази, които най-често се използват в промишлеността, има около 11 съединения, като например основни хидроксиди на натрий, калий, амоний и др.

Структурата на базовата молекула
Между металния катион и анионите на хидроксилната група в молекулата на веществото се образува йонна връзка. Той е достатъчно силен за водонеразтворими хидроксиди, така че полярните водни молекули не са в състояние да унищожат кристалната решетка на такова съединение. Алкали са вещества, които са стабилни и практически не образуват оксид и вода при загряване. Така че основните хидроксиди на калий и натрий кипят при температура над 1000 ° C, докато не се разлагат. В графичните формули на всички основи ясно се вижда, че кислородният атом на хидроксилната група е свързан чрез една ковалентна връзка към металния атом, а другият към водородния атом. Структурата на молекулата и видът на химическото свързване причиняват не само физични, но и всички химични характеристики на веществата. Нека да ги разгледаме по-подробно.
Калций и магнезий и свойствата на техните съединения
И двата елемента са типични представители на активните метали и могат да взаимодействат с кислород и вода. Продуктът от първата реакция е основният оксид. Хидроксид се образува в резултат на екзотермичен процес, като се процедира с отделянето на голямо количество топлина. Базите на калций и магнезий са слабо разтворими бели прахообразни вещества. За калциевото съединение често се използват следните наименования: варово мляко (ако е суспензия във вода) и вар вода. Като типичен основен хидроксид, Ca (OH)2 взаимодейства с киселинни и амфотерни оксиди, киселини и амфотерни основи, например с алуминиеви и цинкови хидроксиди. За разлика от типичните основи, устойчиви на топлина, магнезиевите и калциевите съединения се разлагат на окис и вода под влияние на температурата. И двете бази, особено Са (ОН)2, широко използвани в промишлеността, селското стопанство и вътрешните нужди. Да разгледаме тяхното приложение по-нататък.

Области на приложение на калциеви и магнезиеви съединения
Известно е, че в строителството се използва химически материал, наречен прахообразна или шлакова вар. Това е основата на калций. Най-често се получава при реакцията на водата с основния калциев оксид. Химичните свойства на основните хидроксиди позволяват широкото им използване в различни отрасли на националната икономика. Например, за почистване на примеси в производството на сурова захар, за производство на белина, в избелване памук и лен, прежда. Преди изобретяването на йонообменници - катионобменни, основите на калций и магнезий се използват в технологиите за омекотяване на водата, което позволява да се отърват от хидрокарбонатите, което влошава качеството му. За това водата се вари с малко количество калцинирана сода или хидратирана вар. Водна суспензия на магнезиев хидроксид може да се използва като терапевтичен агент за пациенти с гастрит, за да се намали киселинността на стомашния сок.

Свойства на основни оксиди и хидроксиди
Най-важните за веществата в тази група са реакциите с киселинни оксиди, киселини, амфотерни основи и соли. Интересното е, че неразтворими основи, като например мед, желязо или никелови хидроксиди, не могат да бъдат получени чрез директна реакция на оксида с вода. В този случай реакцията между съответната сол и алкали се използва в лабораторията. В резултат на това се образуват бази, които се утаяват. Така например се получава синя утайка от меден хидроксид - зелена утайка от основата на желязо желязо. След това те се изпаряват до твърди прахообразни вещества, свързани с водонеразтворими хидроксиди. Отличителна черта на тези съединения е, че при въздействието на високите температури те се разлагат в съответния оксид и вода, което не може да се каже за алкали. В крайна сметка водоразтворимите основи са термично стабилни.

Възможност за електролизиране
Продължавайки да изучаваме основните свойства на хидроксидите, ще разгледаме още една особеност, чрез която е възможно да се разграничат основите на алкалните и алкалоземните метали от водонеразтворимите съединения. Това е неспособността на последния да се раздели на йони под действието на електрически ток. Напротив, стопилки и разтвори на калиев, натриев, бариев, стронциев хидроксид лесно преминават електролиза и са проводници от втори вид.
Приготвяне на основи
Говорейки за свойствата на този клас неорганични вещества, ние частично изброихме химичните реакции, които стоят в основата на тяхното производство при лабораторни и промишлени условия. Най-достъпният и икономически изгоден е методът на термично разлагане на естествен варовик, в резултат на което негасена вар. Ако се извършва реакция с вода, тя образува основен хидроксид - Ca (OH)2. Смес от това вещество с пясък и вода се нарича хоросан. Той продължава да се използва за шпакловане на стени, за облицоване на тухли и други видове строителни работи. Алкали могат да се получат и чрез взаимодействие на съответните оксиди с вода. Например: K2О + Н2О = 2КОН. Процесът е екзотермичен с освобождаването на голямо количество топлина.

Взаимодействие на алкали с киселинни и амфотерни оксиди
Характерните химични свойства на водоразтворими основи включват способността им да образуват соли при реакции с оксиди, съдържащи неметални атоми в молекулите, например като въглероден диоксид, серен диоксид или силициев оксид. По-специално, за изтичане на газове се използва калциев хидроксид и натриеви и калиеви хидроксиди за получаване на съответните карбонати. Цинк и алуминиеви оксиди, свързани с амфотерни вещества, могат да взаимодействат както с киселини, така и с основи. В последния случай могат да се образуват сложни съединения, например, като натриев хидрокси-цинкат.
Реакция на неутрализация
Едно от най-важните свойства на базите, неразтворими във вода и алкали, е тяхната способност да реагират с неорганични или органични киселини. Тази реакция се редуцира до взаимодействието на два вида йони: водород и хидроксилни групи. Това води до образуването на водни молекули: HCI + KOH = KCI + H2За. От гледна точка на теорията на електролитната дисоциация, цялата реакция намалява до образуването на слабо дисоцииран електролит - вода.

В този пример се образува средна сол - калиев хлорид. Ако за реакцията се вземат базични хидроксиди в количество, което е по-малко, отколкото е необходимо, за да се неутрализира напълно полисновата киселина, след изпаряване на образувания продукт се откриват кристали на киселинната сол. Реакцията на неутрализация играе важна роля в метаболитните процеси, протичащи в живите системи-клетки и им позволява със свои собствени буферни комплекси да неутрализират излишното количество водородни йони, акумулиращи се в реакциите на дисимилация.
 Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества
Какво има значение? Какви са класовете вещества? Разликата между органични и неорганични вещества Органичните вещества имат своите характеристики и класификация
Органичните вещества имат своите характеристики и класификация Качествени реакции към органични вещества, аниони, катиони
Качествени реакции към органични вещества, аниони, катиони Оксиди, соли, основи, киселини. Свойства на оксиди, основи, киселини, соли
Оксиди, соли, основи, киселини. Свойства на оксиди, основи, киселини, соли Карбоксилни киселини: физични свойства. Соли на карбоксилни киселини
Карбоксилни киселини: физични свойства. Соли на карбоксилни киселини Химия: оксиди, тяхната класификация и свойства
Химия: оксиди, тяхната класификация и свойства Неорганични вещества
Неорганични вещества Каква е същността на оксидите
Каква е същността на оксидите Алкални метали
Алкални метали Органични съединения и тяхната класификация
Органични съединения и тяхната класификация Класове неорганични съединения
Класове неорганични съединения Амфотерни метали и техните свойства
Амфотерни метали и техните свойства Alkanes: химични свойства
Alkanes: химични свойства Основни оксиди и техните свойства
Основни оксиди и техните свойства Химични свойства на бази
Химични свойства на бази Оксиди. Натриеви и несъдържащи сол оксиди
Оксиди. Натриеви и несъдържащи сол оксиди Химични свойства на солите и методи за тяхното получаване
Химични свойства на солите и методи за тяхното получаване Неорганични вещества: примери и свойства
Неорганични вещества: примери и свойства Окиси. Примери, класификация, свойства
Окиси. Примери, класификация, свойства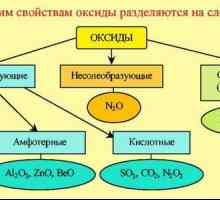 Кислородсъдържащи съединения: примери, свойства, формули
Кислородсъдържащи съединения: примери, свойства, формули Амфотерните хидроксиди са вещества с двойно естество
Амфотерните хидроксиди са вещества с двойно естество